题目内容
为了测定粗盐中氯化钠(混有少量的泥沙及不溶性杂质)的纯度,进行如下实验:a.溶解;b.称量;c.过滤;d.计算;e.蒸发。正确的操作顺序为( )。
A.abcde B.bcaed
C.bacebd D.bdeac
C

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
食盐是日常生活的必需品,也是重要的化工原料.一同学用某种粗盐进行提纯实验,步骤如图所示.
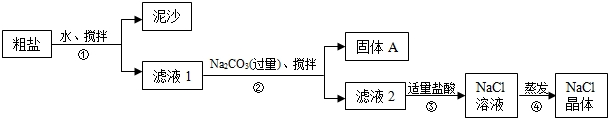
请回答:
(1)步骤①和②的操作名称是 .
(2)步骤②中为得到纯净的固体A,需将沉淀A用水洗涤干净,请设计实验检验沉淀A是否洗净 .
(3)猜想和验证:
(4)我省生产的某种钙盐的配料表如下:氯化钠、食用碳酸钙、碘酸钾.为了测定此盐中的钙元素含量,取10g这种盐溶于水,加入足量盐酸,生成0.132g二氧化碳.请计算此加钙食盐中钙元素的质量分数.

请回答:
(1)步骤①和②的操作名称是
(2)步骤②中为得到纯净的固体A,需将沉淀A用水洗涤干净,请设计实验检验沉淀A是否洗净
(3)猜想和验证:
| 猜想 | 验证方法 | 实验现象 | 结论 |
| 猜想I:固体A中含有CaCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | ___________ | 猜想I成立 |
| 猜想II:固体A中含有BaCO3 |
取少量固体A于试管中,先滴入_________,再滴入稀Na2SO4溶液 | 有气泡放出,无白色沉淀 | ________ |
| 猜想III:最后制得的NaCl晶体中还含有Na2SO4 |
取少量NaCl晶体于试管中,加适量的蒸馏水溶解,再_______ | ________ | 猜想III成立 |
