题目内容
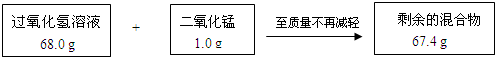
某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,实验测得相关数据如下图所示:

(1)剩余的混合物中二氧化锰的质量为 g,反应生成氧气的质量为 g。
(2)计算该过氧化氢溶液中溶质质量分数。
(3)实验表明硫酸铜溶液在该反应中也能起到二氧化锰的作用。若用5.6g无水硫酸
铜代替二氧化锰进行本实验,计算剩余的溶液中溶质的质量分数。(硫酸铜全部溶于水,计算时保留到0.1%)
【答案】
(1)1.0, 1.6 (每空1分,共2分)
(2)设68.0 g过氧化氢溶液中含有过氧化氢的质量为x。
2H2O2 2 H2O + O2↑
(1分)
2 H2O + O2↑
(1分)
68 32
x 1.6 68:32 = x : 1.6 (1分)
x = 3.4g (1分)
过氧化氢溶液的溶质的质量分数= 3.4g/68.0g ×100% = 5.0% (1分)
(3)硫酸铜溶液的溶质质量分数= 5.6g / (67.4g— 1.0g + 5.6g) ×100% (1分)
≈ 7.8% (1分)
【解析】略

练习册系列答案
相关题目