题目内容
20.相同质量的镁、铝、铁与过量稀硫酸反应,置换出的氢气质量比为( )| A. | 21:28:9 | B. | 12:9:28 | C. | 2:3:2 | D. | 28:9:12 |
分析 两种二价金属与足量硫酸反应得到氢气多少的计算,既可以采用传统的方法直接分别计算,也可以用归一法计算后分析.
解答 解:可以根据化学方程式进行计算;也可根据生成氢气的质量=$\frac{金属的化合价}{金属的相对原子质量}$,则根据镁、铝、铁的相对原子质量为24、27、56,又根据“相同质量的镁、铝、铁与过量稀硫酸反应”,故可知:产生氢气的质量比为=$\frac{2}{24}$:$\frac{3}{27}$:$\frac{2}{56}$=21:28:9.
故选:A.
点评 相同质量的金属与足量的酸反应得到氢气由多到少的顺序为铝镁钙钠铁锌钾.记住这个结论,以便分析与金属活动性以及判断氢气多少的图表题.

练习册系列答案
相关题目
11.下列鉴别方法不能正确区分待鉴别物质的是( )
| 选项 | 待鉴别物质 | 鉴别方法 |
| A | 氮气、二氧化碳 | 分别伸入燃着的木条,观察木条是否熄灭 |
| B | 食盐和碳酸氢铵 | 分别取样加热,闻气味 |
| C | 硬水、软水 | 分别倒入肥皂水并搅拌,观察产生泡沫的情况 |
| D | 铜片、铁片 | 观察颜色 |
| A. | A | B. | B | C. | C | D. | D |
8.家用漂白精的有效成分是NaClO,其中氯元素的化合价为( )
| A. | +1 | B. | +3 | C. | +5 | D. | +7 |
15.下列关于糖类、油脂的说法错误的是( )
| A. | 它们的组成中都有C、H、O、N等元素 | B. | 糖类习惯上可称为碳水化合物 | ||
| C. | 都是人类需要的营养物质 | D. | 都是有机物 |
5.下列家庭实验中不涉及化学变化的是( )
| A. | 用食醋除水垢 | B. | 用糯米制甜酒酿 | C. | 酒精杀菌消毒 | D. | 用木炭去除异味 |
12.下列物质中,属于混合物的是( )
| A. | 氧化镁 | B. | 水和冰相混合 | C. | 生锈的铁钉 | D. | 氯化钾 |
9. 如图是三种微粒的结构示意图,有关它们的说法正确的是( )
如图是三种微粒的结构示意图,有关它们的说法正确的是( )
 如图是三种微粒的结构示意图,有关它们的说法正确的是( )
如图是三种微粒的结构示意图,有关它们的说法正确的是( )| A. | 它们属于同种元素的微粒 | B. | 它们都是原子 | ||
| C. | 它们原子的最外层电子数相同 | D. | 它们原子的电子层不完全相同 |
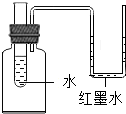 如图所示的装置中,加入氢氧化钠固体,片刻后U型管中左侧液面将下降(填上升、下降或不变),产生这一现象的原因是向水中加入的氢氧化钠溶于水时放热,使瓶内气体压强增大.若用代替氢氧化钠固体,U型管中液面会出现相反的现象.
如图所示的装置中,加入氢氧化钠固体,片刻后U型管中左侧液面将下降(填上升、下降或不变),产生这一现象的原因是向水中加入的氢氧化钠溶于水时放热,使瓶内气体压强增大.若用代替氢氧化钠固体,U型管中液面会出现相反的现象.