题目内容
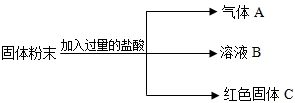
22、有一包固体粉末.可能由CaCO3、Na2SO4、KNO3、CuSO4、BaCl2中的一种或几种组成.有关实验结果如下:
(1)将此固体粉末投入到足量水中,得到白色沉淀,上层清液呈无色;
(2)过滤得白色沉淀,加入过量的稀硝酸,沉淀完全不溶解的.由此判断.原固体粉末中,一定含有
(1)将此固体粉末投入到足量水中,得到白色沉淀,上层清液呈无色;
(2)过滤得白色沉淀,加入过量的稀硝酸,沉淀完全不溶解的.由此判断.原固体粉末中,一定含有
氯化钡和硫酸钠
; 一定没有碳酸钙和硫酸铜
;可能含有硝酸钾
.分析:根据铜离子在溶液中显蓝色,碳酸钙难溶于水,但是会溶于酸,钡离子会与硫酸根离子生成的硫酸钡沉淀难溶于酸进行分析.
解答:解:将此固体粉末投入到足量水中,上层清液呈无色,说明一定不存在硫酸铜,得到的白色沉淀不溶于硝酸,一定不存在碳酸钙,一定存在氯化钡和硫酸钠,对于硝酸钾不会影响题中的现象,所以一定存在氯化钡和硫酸钠,一定不存在碳酸钙和硫酸铜,可能存在硝酸钾,故答案为:氯化钡和硫酸钠,碳酸钙和硫酸铜,硝酸钾.
点评:在解此类题时,首先分析题中的现象物质之间的关系,然后根据现象推出可以确定存在或不存在的物质,对于现象不能确定的只能再设计实验进行验证.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案
相关题目