题目内容
某气体在空气中完全燃烧,生成CO2和H2O的质量比为11:9,则该气体可能是①CH4;②C2H2;③C2H5OH;④CH3OH
- A.①④
- B.②④
- C.①②
- D.①③
A
分析:根根据质量守恒定律可以知道,反应前后元素的质量不变,所以可以根据化学反应前后碳元素和氢元素的质量相等来计算即:二氧化碳的质量乘以二氧化碳中碳元素的质量分数,再除以碳元素的相对原子质量,就可以得到二氧化碳中碳原子的个数,同样可以得到水中氢原子的个数;两者相比得到碳原子和氢原子的个数比,根据质量守恒定律可知这个比就是该有机物中碳、氢元素的原子个数比,并作出判断即可.
解答:根据二氧化碳和水的质量比为11:9,所以可以求算出碳元素和氢元素的质量比为:可计算出碳、氢两种元素的质量比为:(11×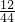 ):(9×
):(9×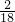 )=3:1,则该化合物中碳、氢的原子个数比是
)=3:1,则该化合物中碳、氢的原子个数比是  :
: =1:4;分析题给的四种化合物满足该条件的为①④,即选项A是正确的.
=1:4;分析题给的四种化合物满足该条件的为①④,即选项A是正确的.
故选A.
点评:本题主要考查有关化学式的计算,难度不大,关键是要学会由物质质量求原子个数比的方法.
分析:根根据质量守恒定律可以知道,反应前后元素的质量不变,所以可以根据化学反应前后碳元素和氢元素的质量相等来计算即:二氧化碳的质量乘以二氧化碳中碳元素的质量分数,再除以碳元素的相对原子质量,就可以得到二氧化碳中碳原子的个数,同样可以得到水中氢原子的个数;两者相比得到碳原子和氢原子的个数比,根据质量守恒定律可知这个比就是该有机物中碳、氢元素的原子个数比,并作出判断即可.
解答:根据二氧化碳和水的质量比为11:9,所以可以求算出碳元素和氢元素的质量比为:可计算出碳、氢两种元素的质量比为:(11×
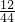 ):(9×
):(9×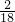 )=3:1,则该化合物中碳、氢的原子个数比是
)=3:1,则该化合物中碳、氢的原子个数比是  :
: =1:4;分析题给的四种化合物满足该条件的为①④,即选项A是正确的.
=1:4;分析题给的四种化合物满足该条件的为①④,即选项A是正确的.故选A.
点评:本题主要考查有关化学式的计算,难度不大,关键是要学会由物质质量求原子个数比的方法.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
(6分)元素组成物质。根据给定元素回答下列问题。
已知:下列物质由氢、碳、氧、磷、钙、钠、铁中的一种或几种元素组成
(1)若某固体在完全燃烧和不完全燃烧时,分别生成甲、乙不同的气体。则该固体的化学式为________。为鉴别甲乙气体,下述方法可行的是___________。(填字母序号)
| a.分别用燃着木条检验 | b.分别通入澄清石灰水中 |
| c.分别通入水中 | d.分别通入石蕊试液中 |
(3)若A、B两种物质组成元素相同A→B→C,则B生成C的化学方程式为_______________________________。
(4)若某物质与盐酸反应生成使澄清石灰水变浑浊的气体,则该物质中一定含____元素。
(5)若某元素单质与稀盐酸反应生成化合物A,又知B与A组成元素相同。工业上用B
和H2在300-350℃时反应可制得A和盐酸,该反应的化学方程式为_______________________________。
学习化学有很多重要方法.
(1)下面是某同学对有关知识的归纳总结:物质类属间存在着如下关系,其中酸和盐属于______关系.

(2)对所学的知识进行自己的理解与建构,并能结合具体示例进行说明是一种很好的学习方法,请仿照示例在“判断与解释”栏中回答有关问题.
| 理解与建构 | 判断与解释 | |
| 例1 | 合成材料地应用与发展,既方便了人类的生活,也带来了“白色污染”等环境问题. | 正确 |
| 例2 | 所有的原子核内都有质子、中子. | 不正确,如:H的原子核内没有中子 |
| 练1 | 把燃着的木条伸入集气瓶中,木条熄灭,则瓶中气体一定是CO2 | ______ |
| 练2 | 一种单质中只含一种元素,一种混合物中可能含有一种元素. | ______ |
| 练3 | 在空气中完全燃烧生成CO2和H2O的有机物,其组成中只含有C、H两种元素. | ______ |

