题目内容
请用化学方程式表示下列化工生产中的变化:
(1)用盐酸洗铁锈
(2)氧化铜粉末与稀硫酸共热
(3)用烧碱溶液吸收二氧化硫气体
(4)用氢氧化铝来中和多余的胃酸(盐酸)
(5)写出硝酸钾的电离方程式
(1)用盐酸洗铁锈
Fe2O3+6HCl═2FeCl3+3H2O
Fe2O3+6HCl═2FeCl3+3H2O
;(2)氧化铜粉末与稀硫酸共热
CuO+H2SO4
CuSO4+H2O
| ||
CuO+H2SO4
CuSO4+H2O
;
| ||
(3)用烧碱溶液吸收二氧化硫气体
SO2+2NaOH═Na2SO3+H2O
SO2+2NaOH═Na2SO3+H2O
;(4)用氢氧化铝来中和多余的胃酸(盐酸)
Al(OH)3+3HCl═AlCl3+3H2O
Al(OH)3+3HCl═AlCl3+3H2O
.(5)写出硝酸钾的电离方程式
KNO3=K++NO3-
KNO3=K++NO3-
.分析:首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.
解答:解:(1)铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O.
(2)氧化铜粉末与稀硫酸共热生成硫酸铜和水,反应的化学方程式是:CuO+H2SO4
CuSO4+H2O.
(3)用烧碱溶液吸收二氧化硫气体生成亚硫酸钠和水,反应的化学方程式是:SO2+2NaOH═Na2SO3+H2O.
(4)用氢氧化铝来中和多余的胃酸(盐酸)生成氯化铝和水,反应的化学方程式是:Al(OH)3+3HCl═AlCl3+3H2O.
(5)硝酸钾电离出钾离子和硝酸根离子,电离方程式为:KNO3=K++NO3-.
故答案为:(1)Fe2O3+6HCl═2FeCl3+3H2O;(2)CuO+H2SO4
CuSO4+H2O;(3)SO2+2NaOH═Na2SO3+H2O;(4)Al(OH)3+3HCl═AlCl3+3H2O;(5)KNO3=K++NO3-.
(2)氧化铜粉末与稀硫酸共热生成硫酸铜和水,反应的化学方程式是:CuO+H2SO4
| ||
(3)用烧碱溶液吸收二氧化硫气体生成亚硫酸钠和水,反应的化学方程式是:SO2+2NaOH═Na2SO3+H2O.
(4)用氢氧化铝来中和多余的胃酸(盐酸)生成氯化铝和水,反应的化学方程式是:Al(OH)3+3HCl═AlCl3+3H2O.
(5)硝酸钾电离出钾离子和硝酸根离子,电离方程式为:KNO3=K++NO3-.
故答案为:(1)Fe2O3+6HCl═2FeCl3+3H2O;(2)CuO+H2SO4
| ||
点评:本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.

练习册系列答案
相关题目
 (1)图为2008年北京奥运会“金镶玉”等奖牌,6000枚奖牌所需黄金13.04吨、银1.34吨和电解铜6.93吨.据介绍,在金属奖牌内环和昆仑玉(含硅酸盐的一种稳定的盐类物质)环的边缘均留有沟槽,沟槽内浇注有类似橡胶的阻尼材料,这样金属和玉就
(1)图为2008年北京奥运会“金镶玉”等奖牌,6000枚奖牌所需黄金13.04吨、银1.34吨和电解铜6.93吨.据介绍,在金属奖牌内环和昆仑玉(含硅酸盐的一种稳定的盐类物质)环的边缘均留有沟槽,沟槽内浇注有类似橡胶的阻尼材料,这样金属和玉就
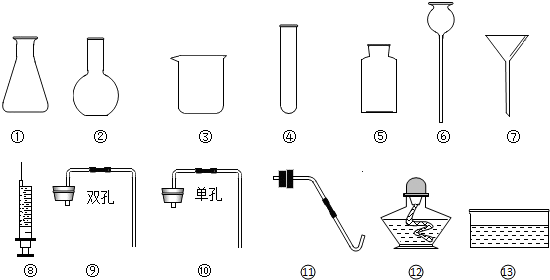
 小红:①⑤⑥⑨小明:④⑤⑧⑩
小红:①⑤⑥⑨小明:④⑤⑧⑩