题目内容
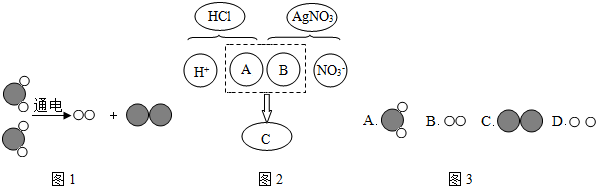
为了回收硝酸亚铁和硝酸银的混合溶液中的银,设计了如图所示的实验方案:
(提示:Fe2+溶液为浅绿色,Ag+、Zn2+溶液都是无色)

(1)若溶液乙为无色,则固体甲中一定有的金属是 ,步骤②中肯定发生的反应的方程式为 .
(2)若溶液乙为浅绿色溶液,则溶液乙中的溶质的组成可能是 或 .
(提示:Fe2+溶液为浅绿色,Ag+、Zn2+溶液都是无色)

(1)若溶液乙为无色,则固体甲中一定有的金属是
(2)若溶液乙为浅绿色溶液,则溶液乙中的溶质的组成可能是
考点:金属的化学性质,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:根据溶液颜色特征,分析流程图中反应的发生情况,对所得固体或溶液组成成分进行分析.
解答:解:(1)溶液乙为无色溶液,可判断溶液乙中不含亚铁离子,则原溶液中的硝酸亚铁被全部置换,根据金属活动性,硝酸银中金属银先于铁被置换出来,因此,原溶液中的硝酸银、硝酸铁全部被置换,反应后所得固体中一定含有被置换出来的金属铁和银;如果加入的锌过量,则固体中含有锌;固体甲中一定含有铁、银,向其加入稀硫酸,则铁与稀硫酸反应,生成硫酸亚铁和氢气;化学方程式为Fe+H2SO4=FeSO4+H2↑;
(2)溶液乙为浅绿色,说明原溶液中的硝酸亚铁没有完全反应,则所加入金属锌量不足;根据盐溶液与金属反应的先后顺序可判断:所加入金属锌和硝酸银溶液完全反应后,继续和硝酸亚铁反应,由于溶液中含有硝酸亚铁,所以不能判断硝酸银溶液是否完全反应.则反应后溶液中所含溶质可能有:硝酸锌、硝酸亚铁或硝酸锌、硝酸亚铁、硝酸银.
故答案为:(1)Ag、Fe,Fe+H2SO4=FeSO4+H2↑;.
(2)Zn(NO3)2、Fe(NO3)2 Zn(NO3)2、Fe(NO3)2、AgNO3
(2)溶液乙为浅绿色,说明原溶液中的硝酸亚铁没有完全反应,则所加入金属锌量不足;根据盐溶液与金属反应的先后顺序可判断:所加入金属锌和硝酸银溶液完全反应后,继续和硝酸亚铁反应,由于溶液中含有硝酸亚铁,所以不能判断硝酸银溶液是否完全反应.则反应后溶液中所含溶质可能有:硝酸锌、硝酸亚铁或硝酸锌、硝酸亚铁、硝酸银.
故答案为:(1)Ag、Fe,Fe+H2SO4=FeSO4+H2↑;.
(2)Zn(NO3)2、Fe(NO3)2 Zn(NO3)2、Fe(NO3)2、AgNO3
点评:活泼金属与盐溶液反应时,会按金属活动性由弱到强的顺序逐一置换.

练习册系列答案
相关题目
水是生命之源,我们应该象珍惜自己的血液一样珍惜每一滴水.下列关于水的说法中正确的是( )
| A、水的天然循环是通过水的三态变化实现的 |
| B、城市污水不必经过净化处理就能排放 |
| C、水是有氢元素和氧元素组成的混合物 |
| D、水资源是宝贵的,一定要节约用水 |