题目内容
11.钢铁是人类利用得最多的金属材料.(1)工业上常用赤铁矿来炼铁,其反应原理是Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2(用化学方程式回答).
(2)若比较铝、铁、铜三种金属的活动性强弱,可以选择下列试剂组AB(填序号).
A.Al、Fe、Cu、20%稀盐酸 B.Al、Cu、FeSO4溶液
C.Al、Fe、CuSO4溶液 D.Fe、Cu、Al2(SO4)3溶液
(3)若将铝、铁、铜三种金属同时放入硝酸铜溶液中.完全反应后,金属铁有余,则此时溶液中的溶质有2种.
分析 (1)根据CO的还原性,完成CO高温还原氧化铁反应的化学方程式;
(2)若要验证三种金属的活动性,如果只用一种溶液,就要选择活动性居中的金属的盐溶液(两头不变,中间变);若要选择一种金属,就要选择活动性居中的金属(中间不变,两头变);
(3)充分反应后Fe过量没有反应完,所以原混合溶液中的Cu(NO3)2全部被置换生成Cu、Al(NO3)3和Fe(NO3)2溶液.
解答 解:(1)CO在高温条件下与氧化铁反应,生成铁和二氧化碳,其反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;故填:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(2)验证三种金属的活动性,选三种药品时,如果只用一种溶液,就要选择活动性居中的金属的盐溶液,即选择硫酸亚铁溶液及金属铝和铜,铝能置换出硫酸亚铁中的铁,而铜不能置换出硫酸亚铁中的铁,说明铝>铁>铜;若要选择一种金属,就要选择活动性居中的金属铁及硫酸铝、硫酸铜溶液,铁能置换出硫酸铜中的铜而不能置换出硫酸铝中的铝,说明铝>铁>铜;根据金属活动性,金属活动性越强与酸的反应越剧烈,铝与硫酸反应,迅速产生大量气泡,铁与硫酸反应较慢,产生气泡较少,铜不与硫酸反应,故说明铝>铁>铜;故选:AB;
(3)根据金属活动性,硝酸铜先和铝反应,再与铁发生反应,铁粉过量,所以说明铝完全反应,一部分铁反应;反应后的溶液中不再含的Cu(NO3)2,而是含有生成的Al(NO3)3、Fe(NO3)2;故溶液中的溶质有2种;
故填:2.
点评 本题很好的考查了金属活动性顺序,让学生自己设计实验并且限制物质的种类,难度较大;此种题型的设计可以利用金属和酸、金属和盐溶液的角度考虑.

| A. | $\frac{12b}{a}$ 千克 | B. | $\frac{12b}{a}$ | C. | $\frac{12a}{b}$ | D. | $\frac{12a}{b}$ 千克 |
资料:硝酸钾的溶解度数据(部分数据已做取整数处理)如表所示:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 溶解度/g | 21 | 32 | 46 | 64 | 86 | 110 | 138 |
(2)A、B、C、D四个烧杯中分别盛有100g水,在40℃时,向四个烧杯中分别加入110g、86g、64g、32g硝酸钾,充分溶解,如图所示.

①(填字母序号)ABC中盛的一定是饱和溶液.
②使B烧杯的溶液升温至50℃时,溶液的质量为186 g.
③采用一种方法使A中的固体恰好溶解.对于最终四个烧杯中的溶液,下列说法正确的是acd(填字母序号).
a.溶剂质量可能相等
b.溶质质量可能相等
c.溶质质量分数可能有相等的
d.烧杯A中的溶液质量分数可能最大
(3)工业上利用电解饱和氯化钠溶液可制得重要化工产品氢氧化钠.氢氧化钠溶液可用于治理含二氧化硫的废气并回收二氧化硫,反应的主要流程如下:

①实际生产中,在一定温度下,配制100t溶质的质量分数为25%的饱和氯化钠溶液,需水的质量为75t.
②以上流程中,可循环使用的物质是氯化钠(NaCl).
③亚硫酸氢钠(NaHSO3)中硫元素的质量分数为30.8%(计算结果精确到0.1%).
| A. | 催化剂只能加快化学反应速率 | |
| B. | 燃烧的三个条件:可燃物、氧气、温度达到着火点 | |
| C. | 人体内葡萄糖被氧化时放出能量,是化学能转变成热能的过程 | |
| D. | 雾霾是由粉尘和直径小于2.5微米的PM2.5等复杂成分组成,雾霾属于混合物 |
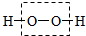 ②H-O-H ③O=C=O ④
②H-O-H ③O=C=O ④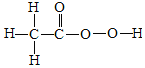

 已知A、B分别是稀硫酸和氢氧化钠溶液中的一种,如图表示向A中加入B时,溶液pH变化曲线.请写出你从曲线图中收获的信息:
已知A、B分别是稀硫酸和氢氧化钠溶液中的一种,如图表示向A中加入B时,溶液pH变化曲线.请写出你从曲线图中收获的信息: