题目内容
19.金属用途广泛,其性质是中学化学学习的重要内容.(1)生铁与钢性能不同,其原因是二者含碳量不同.
(2)铝比较活泼,但铝制品却有很好的抗腐性能,其原因是什么?
(3)农业上不能用铁桶盛放硫酸铜溶液,写出化学方程式Fe+CuSO4=Cu+FeSO4.
(4)若要验证Zn、Cu、Ag三种金属活动性顺序,写出一组合适的试剂Zn、CuSO4、Ag
(5)如图装置可做一氧化碳还原氧化铁的实验.

①A装置玻璃管里可观察到的现象为红色粉末变成黑色;发生反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
②C装置放置酒精灯的作用是点燃尾气中的一氧化碳防止污染空气.
(6)为测定某铜锌合金中铜的质量分数,现称取20g合金放入烧杯中,向其中加入50g稀硫酸,二者恰好完全反应,反应后称量烧杯中剩余物质总质量为69.8g(不包括烧杯的质量,气体溶解忽略不计).试计算该合金中铜的质量分数.
分析 (1)根据生铁与钢的组成分析.
(2)根据铝的性质分析回答;
(3)根据铁、铜的活泼性分析回答;
(4)根据若比较三种金属活动性顺序常用“三取中”的方法分析回答;
(5)根据一氧化碳与氧化铁的反应、现象及注意事项分析回答;
(6)根据质量守恒定律求出生成氢气的质量,根据锌与稀硫酸反应的化学方程式和生成氢气的质量,列出比例式,就可计算出该合金中锌的质量,进而求出铜的质量分数;
解答 解:(1)生铁与钢性能不同,其原因是二者含碳量不同.
(2)铝比较活泼,但铝制品却有很好的抗腐性能,其原因是:铝与空气中的氧气反应生成致密的氧化铝薄膜,阻止了反应的进一步的进行;
(3)农业上不能用铁桶盛放硫酸铜溶液,原因是铁与硫酸铜反应生成了硫酸亚铁和铜,化学方程式是:Fe+CuSO4=Cu+FeSO4.
(4)若要验证Zn、Cu、Ag三种金属活动性顺序,常用“三取中”的方法,可以取两边金属的单质和中间金属的盐溶液,所以合适的试剂可以是:Zn、CuSO4、Ag;
(5)①由于在高温条件下一氧化碳还原氧化铁生成了铁和二氧化碳,所以A装置玻璃管里可观察到的现象为:红色粉末变成黑色,发生反应的化学方程式为 Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
②由于尾气中含有一氧化碳有毒,能污染空气,所以C装置放置酒精灯的作用是:点燃尾气中的一氧化碳,防止污染空气.
(6)由质量守恒定律可知,生成氢气的质量为:20g+50g-69.8g=0.2g
设参加反应的锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
$\frac{65}{2}=\frac{x}{0.2g}$ 解得:x=6.5g
合金中铜的质量分数是:$\frac{20g-6.5g}{20g}×100%$=67.5%
故答为:(1)碳量.
(2)铝与空气中的氧气反应生成致密的氧化铝的薄膜,阻止了反应的进一步的进行;
(3)Fe+CuSO4=Cu+FeSO4.
(4)Zn、CuSO4、Ag;
(5)①:红色粉末变成黑色;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
②点燃尾气中的一氧化碳防止污染空气.
(6)67.5%.
点评 本题比较全面地考查了金属的性质、金属活泼性顺序表的应用、金属的冶炼等知识,难度不大,加强金属知识的学习,有利于解答本类题.

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案| A. | NH3 | B. | N2O3 | C. | N2 | D. | NH4NO3 |
| A. | Mg+O2$\frac{\underline{\;点燃\;}}{\;}$MgO2 | B. | 2Fe+6HCl═2FeCl3+3H2↑ | ||
| C. | Cu+H2SO4═CuSO4+H2↑ | D. | 4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5 |
| A. | 铁产生的氢气多 | B. | 锌反应的较快 | ||
| C. | 铁反应消耗的盐酸质量多 | D. | 铁和锌消耗的盐酸质量相等 |
| A. | 它是使常用建筑材料保持整洁美观的保护层 | |
| B. | 它是易降解的新型塑料,不会形成白色污染 | |
| C. | 它的组成中含有碳分子、氢分子和氟分子 | |
| D. | 它属于天然有机高分子材料 |
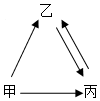 甲、乙、丙是初中化学常见的三种物质,都含有地壳中含量最多的元素,其相互转化关系如图(其反应条件略),丙是单质,则甲的化学式为H2O2,乙转化为丙的化学方程式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,甲、乙两种物质组成元素相同,性质却不相同,其原因是分子构成不同,性质不同.
甲、乙、丙是初中化学常见的三种物质,都含有地壳中含量最多的元素,其相互转化关系如图(其反应条件略),丙是单质,则甲的化学式为H2O2,乙转化为丙的化学方程式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,甲、乙两种物质组成元素相同,性质却不相同,其原因是分子构成不同,性质不同.




 已知A、B、C、D、E、F是六种常见的物质,其中A是黑色固体,B是无色、无味的有毒气体,它们之间的相互转化关系如图,请回答:
已知A、B、C、D、E、F是六种常见的物质,其中A是黑色固体,B是无色、无味的有毒气体,它们之间的相互转化关系如图,请回答: