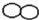��Ŀ����
С�������������к�����������Һ����ʵ��ʱ���μ�����ǰ���˼���ָʾ�����������жϸ��кͷ�Ӧ���еij̶ȣ���������������Һ������Խ���̽����
��̽��Ŀ�ġ�̽��������Һ�������
��������롿������Һ���ܳʼ��ԣ�Ҳ���ܳ����ԣ������ܳ����С��ԣ�
| ʵ����� | ʵ������ | ���� |
| ���Թ�ȡ����Һ1��2mL������1��2����ɫ��̪��Һ���� | ��ɫ��̪��Һ������ | ��Һ�ʼ��� |
| ��ɫ��̪��Һ����ɫ | ��Һ������ |
��������˼����
��1������Һ�ʼ��ԣ�����Һ��ʹ��ʼ��Ե���������������д�����ţ���
��2������ɫ��̪��Һ����ɫ��Ϊ�˽�һ��ȷ����Һ������ԣ�С����������·�����
����һ��ȡ��������̼������Һ�����۲쵽����������ȡ��Һ�����������÷�Ӧ�Ļ�ѧ����ʽΪ������������������������ԣ�
��������ȡ�����������п���������ݲ���������ȡ��Һ�����ԣ��÷�Ӧ�Ļ�ѧ����ʽΪ������������������������ԣ�
����������������롿����������Һ��ϡ�����Ϻ���Ϊ����ȷ����Ӧ�������������Һ�����ԡ����ԡ����Զ��п��ܣ�
[ʵ����֤]��ɫ�ķ�̪��Һ������Һ����ɫ��������Һ��ɺ�ɫ��
��������˼����
����Һ�Լ��ԣ���Һ��һ�����������ƣ�����Һ�����ԣ���Һ��һ�������ᣮ�����������ӷ�Ӧ���ɳ���������һ����ͭ���ӡ������ӡ�þ���ӣ�
����𡿽⣺��������롿�������������ƻ�ϣ��ᷢ����Ӧ�����ڼ������������̶�����Һ���ܳʼ��ԡ����Ի����ԣ��ʴ�Ϊ���У�
[ʵ����֤]��̪�ڼ�����Һ�б�죬�����Ժ�������Һ��Ϊ��ɫ���ʴ�Ϊ��
| ʵ����� | ʵ������ | ���� |
| ���Թ�ȡ����Һ1��2mL������1��2����ɫ��̪��Һ���� | ��ɫ��̪��Һ��� | ��Һ�ʼ��� |
| ��ɫ��̪��Һ����ɫ | ��Һ�����Ի����� |
��������˼����
��1����Һ�ʼ��Ե�ʵ�������������ӵ�Ե�ʣ��ʴ�Ϊ��OH����
��2������һ��ȡ��������̼������Һ�����۲쵽�����ݲ���������ȡ��Һ����������̼������ϡ���ᷢ�����ֽⷴӦ�������Ȼ��ơ�������̼�����ˮ���÷�Ӧ�Ļ�ѧ����ʽΪNa2CO3+2HCl�T2NaCl+H2O+CO2����������������������ԣ�
��������ȡ�����������п���������ݲ���������ȡ��Һ�����ԣ��÷�Ӧп������ᷴӦ�����������仯ѧ����ʽΪZn+2HCl�TZnCl2+H2����������������������ԣ�
�ʴ�Ϊ��
��������롿�У�
| ʵ����� | ʵ������ | ���� |
| �� | ||
| ���Ի����� |
��������˼����
��1��OH������2�������ݲ�����Na2CO3+2HCl�T2NaCl+H2O+CO2����Zn+2HCl�TZnCl2+H2����
��




 ����ʾ��ԭ�ӣ��á�
����ʾ��ԭ�ӣ��á�
 ����ʾ��ԭ�ӣ����������ܱ���ˮ��ѧ���ʵ��ǣ�������
����ʾ��ԭ�ӣ����������ܱ���ˮ��ѧ���ʵ��ǣ�������
 B��
B��
 D��
D��