题目内容
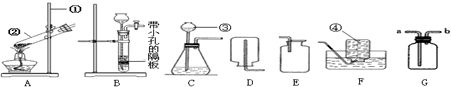
由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不符合电解要求,因此必须经过精制.以粗盐为原料的“氯碱工业”流程如下:

回答下列问题:
(1)操作②的名称是________,操作④的名称是________.
(2)操作①②间除杂质时所加的三种试剂是NaOH溶液、Na2CO3溶液、BaCl2溶液(均过量),其顺序要求是:Na2CO3溶液必须在BaCl2溶液之________(填“前”或“后”)加入.
有同学提出用________溶液代替BaCl2溶液可达到同样的目的.
(3)除去氯化镁的化学方程式________.
(4)电解饱和NaCl溶液的化学方程式是________.
(5)该流程中可以循环利用的物质是________.
解:(1)过滤是将固体和液体进行分离的一种操作,故操作②为过滤,经过操作④后溶液由不饱和变成了饱和状态,说明水分减少了,故操作④的名称是蒸发;
(2)加入氢氧化钠是为了除去氯化镁,加入氯化钡是为了除去硫酸钠,加入碳酸钠是为了除去剩余的氯化钡和氯化钙,顺序加反后,剩余的氯化钡也就成了杂质,其中加入氢氧化钠和氯化钡的顺序可以颠倒;氢氧化钡能与氯化镁和硫酸钠反应,所以,可以用氢氧化钡溶液代替BaCl2溶液可达到同样的目的;
(3)氯化镁和氢氧化钠反应生成氯化钠和氢氧化镁沉淀,化学方程式2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
(4)饱和的氯化钠在通电的条件下生成氯化钠、氢气和氯气,故化学方程式为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(5)根据装置图可以看出,电解反应后的溶液中依然存在氯化钠,氯化钠蒸发变成饱和状态时又可以电解,所以,该流程中可以循环利用的物质是氯化钠.
故答案为:(1)过滤;蒸发; (2)后;氢氧化钡;(3)2NaOH+MgCl2=Mg(OH)2↓+2NaCl;(4)2NaCl+2H2O 2NaOH+H2↑+Cl2↑; (5)氯化钠.
2NaOH+H2↑+Cl2↑; (5)氯化钠.
分析:(1)根据经过操作②后分出了溶液和固体进行分析,根据经过操作④后溶液由不饱和变成了饱和状态进行分析;
(2)根据氯化钡、碳酸钠所除去的离子和除杂质的原则进行分析;
(3)根据氯化镁和氢氧化钠反应生成氯化钠和氢氧化镁沉淀进行解答;
(4)根据反应物、生成物以及反应条件书写方程式;
(5)根据该反应的流程图进行分析.
点评:本题主要考查了粗盐提纯时的物质的除杂和净化,在除杂质时不要引入新的杂质,了解混合物的分离和除杂的方法.
(2)加入氢氧化钠是为了除去氯化镁,加入氯化钡是为了除去硫酸钠,加入碳酸钠是为了除去剩余的氯化钡和氯化钙,顺序加反后,剩余的氯化钡也就成了杂质,其中加入氢氧化钠和氯化钡的顺序可以颠倒;氢氧化钡能与氯化镁和硫酸钠反应,所以,可以用氢氧化钡溶液代替BaCl2溶液可达到同样的目的;
(3)氯化镁和氢氧化钠反应生成氯化钠和氢氧化镁沉淀,化学方程式2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
(4)饱和的氯化钠在通电的条件下生成氯化钠、氢气和氯气,故化学方程式为:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;(5)根据装置图可以看出,电解反应后的溶液中依然存在氯化钠,氯化钠蒸发变成饱和状态时又可以电解,所以,该流程中可以循环利用的物质是氯化钠.
故答案为:(1)过滤;蒸发; (2)后;氢氧化钡;(3)2NaOH+MgCl2=Mg(OH)2↓+2NaCl;(4)2NaCl+2H2O
 2NaOH+H2↑+Cl2↑; (5)氯化钠.
2NaOH+H2↑+Cl2↑; (5)氯化钠.分析:(1)根据经过操作②后分出了溶液和固体进行分析,根据经过操作④后溶液由不饱和变成了饱和状态进行分析;
(2)根据氯化钡、碳酸钠所除去的离子和除杂质的原则进行分析;
(3)根据氯化镁和氢氧化钠反应生成氯化钠和氢氧化镁沉淀进行解答;
(4)根据反应物、生成物以及反应条件书写方程式;
(5)根据该反应的流程图进行分析.
点评:本题主要考查了粗盐提纯时的物质的除杂和净化,在除杂质时不要引入新的杂质,了解混合物的分离和除杂的方法.

练习册系列答案
相关题目
 CO2
CO2