题目内容
下表是元素周期表的部分信息,请回答下列问题:
| 1H 氢 | 2He 氦 | |||||||
| 3Li 锂 | 4Be 铍 | 5B 硼 | 6C 碳 | 7N 氮 | 8 O 氧 | 9 F 氟 | 10Ne 氖 | |
| llNa 钠 | 12Mg 镁 | 13A1 铝 | 14Si 硅 | 15P 磷 | 16S 硫 | 17C1 氯 | 18Ar 氩 | |
| 19K 钾 | XCa 钙 | … | ||||||
(2)分析上表可发现:每一横行元素从左向右排列所遵循的一条规律是________,根据此规律,可知图中X=________.你还获取了哪些信息或规律(只写一条)________.
(3)某物质经分析只含有8号元素,则该物质________ (填序号).
A.一定是单质 B.一定是化合物 C.可能是混合物.
解:(1)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,可知地壳中含量最多的元素为氧,原子序数为8;故答案为:8;
(2)根据元素周期律:每一横行元素从左向右原子序数依次增加;可得图中的x=20;
分析元素周期表可得:元素周期表中每一个周期都从金属元素开始,到稀有气体元素结束(第一周期从非金属元素氢开始);故答案为:原子序数依次增加;20;元素周期表中每一个周期都从金属元素开始,到稀有气体元素结束(第一周期从非金属元素氢开始);
(3)8号元素为氧元素,由氧元素组成的物质有氧气以及臭氧,所以只含有8号元素,则该物质可能是单质或混合物,但一定不是化合物,故选:C.
分析:(1)地壳中含量最多的元素是氧元素;
(2)根据元素周期律:每一横行元素从左向右原子序数依次增加;元素周期表中每一个周期都从金属元素开始,到稀有气体元素结束(第一周期从非金属元素氢开始);进行解答;
(3)根据氧元素组成的物质进行解答.
点评:本题主要考查地壳里各元素的含量、质子数与核外电子数的关系,并能应用于解题.
(2)根据元素周期律:每一横行元素从左向右原子序数依次增加;可得图中的x=20;
分析元素周期表可得:元素周期表中每一个周期都从金属元素开始,到稀有气体元素结束(第一周期从非金属元素氢开始);故答案为:原子序数依次增加;20;元素周期表中每一个周期都从金属元素开始,到稀有气体元素结束(第一周期从非金属元素氢开始);
(3)8号元素为氧元素,由氧元素组成的物质有氧气以及臭氧,所以只含有8号元素,则该物质可能是单质或混合物,但一定不是化合物,故选:C.
分析:(1)地壳中含量最多的元素是氧元素;
(2)根据元素周期律:每一横行元素从左向右原子序数依次增加;元素周期表中每一个周期都从金属元素开始,到稀有气体元素结束(第一周期从非金属元素氢开始);进行解答;
(3)根据氧元素组成的物质进行解答.
点评:本题主要考查地壳里各元素的含量、质子数与核外电子数的关系,并能应用于解题.

练习册系列答案
相关题目
元素周期律是学习和研究化学的重要工具.下表是元素周期表的部分信:
认真分析信息,回答:
(1)分析上表规律,可推知,表中X=______;
(2)地壳中含量最多的金属元素的原子核内质子数是______,该元素的氧化物化学式为______.
(3)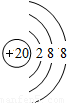 表示的是(写粒子符号)______.
表示的是(写粒子符号)______.
(4)实验证明:在上表同一横行中,从左到右,原子失去电子的能力逐渐减弱,得电子能力逐渐增强;同一纵行中,从上到下,原子失去电子的能力逐渐增强,得电子能力逐渐减弱.则上图元素中失去电子能力最强的元素原子是______(填原子符号,下同),得电子能力最强的元素原子是______.
| 1 H 氢 |  | 2 He 氦 | ||||||
| 3 Li 锂 | 4 Be 铍 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | |
| 11 Na 钠 | 12 Mg 镁 | 13 Al 铝 | 14 Si 硅 | 15 P 磷 | 16 S 硫 | X Cl 氯 | 18 Ar 氩 | |
| 19 K 钾 | 20 Ca 钙 | … | ||||||
(1)分析上表规律,可推知,表中X=______;
(2)地壳中含量最多的金属元素的原子核内质子数是______,该元素的氧化物化学式为______.
(3)
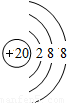 表示的是(写粒子符号)______.
表示的是(写粒子符号)______.(4)实验证明:在上表同一横行中,从左到右,原子失去电子的能力逐渐减弱,得电子能力逐渐增强;同一纵行中,从上到下,原子失去电子的能力逐渐增强,得电子能力逐渐减弱.则上图元素中失去电子能力最强的元素原子是______(填原子符号,下同),得电子能力最强的元素原子是______.

 表示的是(写粒子符号)
表示的是(写粒子符号)
 表示的是(写粒子符号)
表示的是(写粒子符号)
 ,写出X的离子符号
,写出X的离子符号 .X与Y形成化合物的化学式为
.X与Y形成化合物的化学式为
 ,写出X的离子符号______;元素 Y的原子结构示意图为
,写出X的离子符号______;元素 Y的原子结构示意图为  .X与Y形成化合物的化学式为______.
.X与Y形成化合物的化学式为______.