题目内容
5.小亮同学用过氧化氢溶液在二氧化锰催化作用下制取氧气,实验台上有5%和25%两种浓度的过氧化氢溶液,他称取了3g二氧化锰分别进行实验.(1)在催化作用下,过氧化氢溶液浓度与生成氧气速率的关系是过氧化氢溶液浓度越大,生成氧气速率越大,实验结束后分离出二氧化锰的操作是过滤;
(2)请选择合适浓度的过氧化氢溶液制取3.2g氧气,计算需要该浓度过氧化氢溶液的质量是多少.
分析 (1)过氧化氢溶液浓度越大,生成氧气速率越大;二氧化锰作为催化剂,反应前后质量和化学性质不变,且不溶于水,可用过滤法分离;
(2)用5%的过氧化氢溶液制取氧气,根据化学方程式进行计算.
解答 解:(1)过氧化氢溶液浓度越大,生成氧气速率越大;二氧化锰作为催化剂,反应前后质量和化学性质不变,且不溶于水,可用过滤法分离;
故填:过氧化氢溶液浓度越大,生成氧气速率越大;过滤;
(2)用5%的过氧化氢溶液制取氧气,设需要过氧化氢的质量为x
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
68 32
x 3.2g
$\frac{68}{32}=\frac{x}{3.2g}$
x=6.8g
需要该浓度过氧化氢溶液的质量是:$\frac{6.8g}{5%}$=136g
答:需要该浓度过氧化氢溶液的质量是136g.
点评 利用溶液中溶质质量分数计算公式,由溶质的质量及溶液的质量分数可计算溶液的质量.

练习册系列答案
相关题目
13.下列化学反应中既属于化合反应,又属于氧化反应的是( )
| A. | 镁+氧气$\stackrel{点燃}{→}$氧化镁 | B. | 高锰酸钾$\stackrel{△}{→}$锰酸钾+二氧化锰+氧气 | ||
| C. | 石蜡+氧气$\stackrel{点燃}{→}$二氧化碳+水 | D. | 氢气+四氧化三铁$\stackrel{△}{→}$铁+水 |

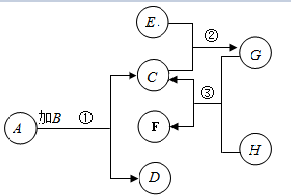 已知A,B,C,D,E,F,G,H是初中化学中常见的8中物质,其中B是黑色固体,D是紫红色固体,G不含碳元素,③不是复分解反应,相关物质在一定条件下转化关系如图:
已知A,B,C,D,E,F,G,H是初中化学中常见的8中物质,其中B是黑色固体,D是紫红色固体,G不含碳元素,③不是复分解反应,相关物质在一定条件下转化关系如图: