题目内容
课外活动小组的同学对学校附近的赤铁矿中Fe2O3含量进行测定.取样品20g加到309g盐酸中,恰好完全反应后,经过滤、干燥、称重,得滤渣的质量为4g(杂质不与盐酸反应)。请计算:
(1)赤铁矿中Fe2O3的质量分数。
(2)反应后所得滤液中溶质的质量分数。
(1)赤铁矿中Fe2O3的质量分数。
(2)反应后所得滤液中溶质的质量分数。
(1)赤铁矿中Fe2O3的质量为:20g-4g=16g
赤铁矿中Fe2O3的质量分数: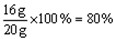
(2)设滤液中FeCl3的质量为x。
Fe2O3+6HCl==2FeCl3+3H2O
160 2×162.5
16g x
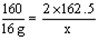
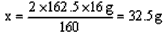
滤液中溶质的质量分数为: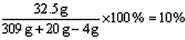
赤铁矿中Fe2O3的质量分数:
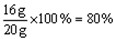
(2)设滤液中FeCl3的质量为x。
Fe2O3+6HCl==2FeCl3+3H2O
160 2×162.5
16g x
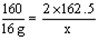
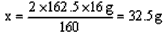
滤液中溶质的质量分数为:
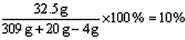

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某课外活动小组的同学对一批钢铁样品(含杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行了实验,其中只有一位同学所取的稀硫酸与样品恰好完全反应,实验数据如下:
请你根据所给数据,回答下列问题:
(1)所取的稀硫酸与钢铁样品恰好完全反应的是 同学.
(2)该钢铁样品中含铁的质量分数为多少?
| 甲 | 乙 | 丙 | |
| 烧杯+稀硫酸 | 200g | 150g | 150g |
| 加入的钢铁样品 | 9g | 9g | 14g |
| 充分反应后,烧杯+剩余物 | 208.7g | 158.7g | 163.7g |
(1)所取的稀硫酸与钢铁样品恰好完全反应的是
(2)该钢铁样品中含铁的质量分数为多少?

