题目内容
为了测定某种黄铜(铜和锌的合金)的组成,取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表:

(1)第2次测得剩余固体质量为74g,其成分为 。
A.铜 B.锌 C.铜和锌
(2)该黄铜样品中铜和锌的质量比m铜:m锌: 。
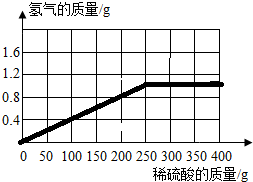
(3)计算所用稀硫酸的溶质质量分数,并画出反应生成的氢气质量与加入稀硫酸质量的关系图。
A.铜 B.锌 C.铜和锌
(2)该黄铜样品中铜和锌的质量比m铜:m锌: 。
(3)计算所用稀硫酸的溶质质量分数,并画出反应生成的氢气质量与加入稀硫酸质量的关系图。

(1)C
(2)27:13
(3)解:设参加反应的H2SO4质量是x
参加反应的锌的质量是100g-87g=13g
Zn + H2SO4===ZnSO4 + H2↑
65 98
13g x
 x=19.6g
x=19.6g
 ×100%=19.6%
×100%=19.6%
答:所用稀硫酸中溶质的质量分数是19.6%。

(2)27:13
(3)解:设参加反应的H2SO4质量是x
参加反应的锌的质量是100g-87g=13g
Zn + H2SO4===ZnSO4 + H2↑
65 98
13g x
 x=19.6g
x=19.6g ×100%=19.6%
×100%=19.6%答:所用稀硫酸中溶质的质量分数是19.6%。


练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
为了测定某种黄铜(铜和锌的合金)的组成,取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表:
试计算所用稀硫酸的溶质质量分数.
| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加入稀硫酸质量(g) | 100 | 100 | 100 | 100 |
| 剩余固体质量(g) | 87 | 74 | 67.5 | 67.5 |
为了测定某种黄铜(铜和锌的合金)的组成,取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表:
| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加入稀硫酸质量(g) | 100 | 100 | 100 | 100 |
| 剩余固体质量(g) | 87 | 74 | 67.5 | 67.5 |
为了测定某种黄铜(铜和锌的合金)的组成,取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表:
(1)第2次测得剩余固体质量为74g,其成分为______.
A.铜 B.锌 C.铜和锌
(2)该黄铜样品中铜和锌的质量比m铜:m锌:______.
(3)计算所用稀硫酸的溶质质量分数,并画出反应生成的氢气质量与加入稀硫酸质量的关系图.______.
| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加入稀硫酸质量(g) | 100 | 100 | 100 | 100 |
| 剩余固体质量(g) | 87 | 74 | 67.5 | 67.5 |
A.铜 B.锌 C.铜和锌
(2)该黄铜样品中铜和锌的质量比m铜:m锌:______.
(3)计算所用稀硫酸的溶质质量分数,并画出反应生成的氢气质量与加入稀硫酸质量的关系图.______.

为了测定某种黄铜(铜和锌的合金)的组成,取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表:
试计算所用稀硫酸的溶质质量分数.
| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加入稀硫酸质量(g) | 100 | 100 | 100 | 100 |
| 剩余固体质量(g) | 87 | 74 | 67.5 | 67.5 |
 (2012?乐陵市二模)为了测定某种黄铜(铜和锌的合金)的组成,取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表:
(2012?乐陵市二模)为了测定某种黄铜(铜和锌的合金)的组成,取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表: