题目内容
现有下列试剂:①蒸馏水,②AgNO3溶液,③BaCl2溶液,④稀HNO3,
欲检验硝酸银固体中是否含有少量可溶性盐酸盐杂质,应选用的试剂是 .
欲检验硝酸银固体中是否含有少量可溶性盐酸盐杂质,应选用的试剂是
考点:证明盐酸和可溶性盐酸盐
专题:物质的检验、鉴别与推断
分析:根据已有的碳酸盐的检验方法进行分析解答即可,碳酸盐遇酸化气,据此解答.
解答:解:检验硝酸银固体中是否含有少量可溶性盐酸盐杂质,因为碳酸盐能与酸反应生成二氧化碳气体,故可以使用稀硝酸,将固体溶于水,加入稀硝酸,如有气体产生则含有碳酸盐,故填:①④.
点评:本题考查的是碳酸盐的检验,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
下列物质中前者属于单质,后者属于混合物的一组的是( )
| A、氧化汞、氧气 |
| B、糖水、白酒 |
| C、氮气、稀有气体 |
| D、铁矿石、水 |
为使灯泡耐用,灯泡里常充入( )
| A、氮气 | B、氧气 |
| C、二氧化碳 | D、稀有气体 |
下列关于化学的相关看法错误的是( )
| A、化学科学的发展必然导致生态环境的恶化 |
| B、化学科学为工业发展提供了更多的原材料和动力 |
| C、实现物质或能量的转化是人们开展化学研究的重要任务 |
| D、绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 |
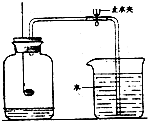 (1)用如图所示装置测定空气里氧气含量时,红磷熄灭后,打开止水夹后,发现最终盛入集气瓶的水的体积小于
(1)用如图所示装置测定空气里氧气含量时,红磷熄灭后,打开止水夹后,发现最终盛入集气瓶的水的体积小于

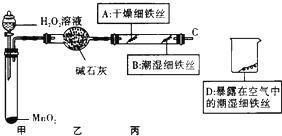 全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一.下面是对铁的腐蚀条件及铁锈组成的探究.
全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一.下面是对铁的腐蚀条件及铁锈组成的探究.