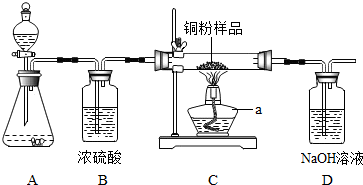
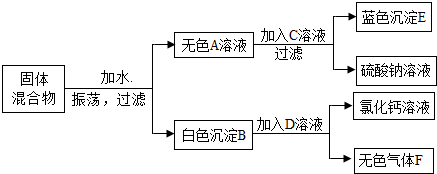
题目内容
某实验小组的同学用氢氧化钙溶液和稀盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸,一会发现忘记了滴加指示剂,因此,他们停止滴加稀盐酸,并对烧杯内的溶液中的溶质成分进行探究.
(1)氢氧化钙溶液和稀盐酸反应的化学方程式: .
(2)探究烧杯内溶液中溶质的成分.
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想与假设】猜想①:溶质是CaCl2和Ca(OH)2;
猜想②:溶质是CaCl2;
猜想③:溶质是 .
【查阅资料】氯化钙溶液呈中性.
【实验探究】
I.小红从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞溶液,振荡,观察到无色酚酞溶液不变色.于是她排出了猜想①,你认为她排出猜想①的理由是 .
II.为了进一步确定溶液的成分,请你设计实验,填写如表实验报告.
通过实验探究,最后确定猜想③是正确的.
【反思与拓展】
①该烧杯中的溶液未经处理不能直接倒入下水道,若要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的 .
②在分析反应后所得溶液中溶质的成分时,除考虑生成物外,还需要考虑 .
(1)氢氧化钙溶液和稀盐酸反应的化学方程式:
(2)探究烧杯内溶液中溶质的成分.
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想与假设】猜想①:溶质是CaCl2和Ca(OH)2;
猜想②:溶质是CaCl2;
猜想③:溶质是
【查阅资料】氯化钙溶液呈中性.
【实验探究】
I.小红从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞溶液,振荡,观察到无色酚酞溶液不变色.于是她排出了猜想①,你认为她排出猜想①的理由是
II.为了进一步确定溶液的成分,请你设计实验,填写如表实验报告.
| 实验步骤 | 预计实验现象 | 预计实验结论 |
| |
猜想②正确 | |
| 猜想③正确 |
【反思与拓展】
①该烧杯中的溶液未经处理不能直接倒入下水道,若要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的
②在分析反应后所得溶液中溶质的成分时,除考虑生成物外,还需要考虑
考点:实验探究物质的组成成分以及含量,酸的化学性质,碱的化学性质,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:(1)根据氢氧化钙和盐酸反应生成了氯化钙和水写出反应的方程式;
(2)猜想③根据反应的程度进行猜想:恰好反应、一种物质完全反应,另一种物质有剩余;
【实验探究】
Ⅰ根据酚酞遇碱变红来进行解答;
Ⅱ根据盐酸的化学性质分析;
【反思与拓展】
(1)根据盐酸的性质进行分析,但注意不能引进其它的金属离子;
(2)根据实验的结论进行发生反思;
(2)猜想③根据反应的程度进行猜想:恰好反应、一种物质完全反应,另一种物质有剩余;
【实验探究】
Ⅰ根据酚酞遇碱变红来进行解答;
Ⅱ根据盐酸的化学性质分析;
【反思与拓展】
(1)根据盐酸的性质进行分析,但注意不能引进其它的金属离子;
(2)根据实验的结论进行发生反思;
解答:解:
(1)氢氧化钙和盐酸反应生成了氯化钙和水,因此反应的方程式为:Ca(OH)2+2HCl═CaCl2+2H2O;
(2)猜想:反应可能是恰好反应,只有氯化钙、也可能是一种物质完全反应,另一种物质有剩余,若氢氧化钙过量,则含有氢氧化钙和氯化钙;若盐酸过量,则含有盐酸和氯化钙;
【实验探究】Ⅰ因为酚酞遇碱会变红色,无色酚酞溶液不变色,说明反应后的溶液不呈碱性.而猜想①中含有Ca(OH)2,溶液应呈碱性,所以排除猜想①;
Ⅱ根据盐酸的化学性质可设计实验如下:
【反思与拓展】
(1)除去溶液中的盐酸可用适量的碳酸钙,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳;
(2)因为反应可能是完全反应,也可能是其中的一种反应物过量,因此在分析化学反应后所得物质成分时,除考虑生成物外还需考虑反应物的用量;
故答案为:
(1)Ca(OH)2+2HCl═CaCl2+2H2O
(2)【猜想与假设】CaCl2、HCl【实验探究】
Ⅰ.无色酚酞溶液不变色,说明反应后的溶液不呈碱性.而猜想①中含有Ca(OH)2,溶液应呈碱性,所以排除猜想①(其他合理答案也可)
Ⅱ.
【其他合理答案及表述也可,例如:可以选用锌粒等活泼金属、氧化铜(或氧
化铁)等金属氧化物、氢氧化铜(或氢氧化铁)等碱、碳酸钠等碳酸盐】
【反思与拓展】①CaCO3(或碳酸钙、石灰石等合理答案)②反应物用量(或反应物过量、反应物剩余等合理答案)
(1)氢氧化钙和盐酸反应生成了氯化钙和水,因此反应的方程式为:Ca(OH)2+2HCl═CaCl2+2H2O;
(2)猜想:反应可能是恰好反应,只有氯化钙、也可能是一种物质完全反应,另一种物质有剩余,若氢氧化钙过量,则含有氢氧化钙和氯化钙;若盐酸过量,则含有盐酸和氯化钙;
【实验探究】Ⅰ因为酚酞遇碱会变红色,无色酚酞溶液不变色,说明反应后的溶液不呈碱性.而猜想①中含有Ca(OH)2,溶液应呈碱性,所以排除猜想①;
Ⅱ根据盐酸的化学性质可设计实验如下:
| 实验步骤 | 预计实验现象 | 预计实验结论 |
| 从烧杯中取少量反应后的溶液 于试管中,滴入1~2滴紫色石 蕊溶液,振荡 |
紫色石蕊溶液不变色 | 猜想②正确 |
| 紫色石蕊溶液变红 | 猜想③正确 |
(1)除去溶液中的盐酸可用适量的碳酸钙,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳;
(2)因为反应可能是完全反应,也可能是其中的一种反应物过量,因此在分析化学反应后所得物质成分时,除考虑生成物外还需考虑反应物的用量;
故答案为:
(1)Ca(OH)2+2HCl═CaCl2+2H2O
(2)【猜想与假设】CaCl2、HCl【实验探究】
Ⅰ.无色酚酞溶液不变色,说明反应后的溶液不呈碱性.而猜想①中含有Ca(OH)2,溶液应呈碱性,所以排除猜想①(其他合理答案也可)
Ⅱ.
| 实验步骤 | 预计实验现象 | 预计实验结论 |
| 从烧杯中取少量反应后的溶液 于试管中,滴入1~2滴紫色石 蕊溶液,振荡 |
紫色石蕊溶液不变色 | 猜想②正确 |
| 紫色石蕊溶液变红 | 猜想③正确 |
化铁)等金属氧化物、氢氧化铜(或氢氧化铁)等碱、碳酸钠等碳酸盐】
【反思与拓展】①CaCO3(或碳酸钙、石灰石等合理答案)②反应物用量(或反应物过量、反应物剩余等合理答案)
点评:本题考查了酸碱中和反应以及实验设计的能力.设计实验时,可以从反应后的产物和其有关的性质着手

练习册系列答案
相关题目
金属钛(Ti)是一种具有许多优良性能的且比较昂贵的金属,被认为是21世纪的重要金属材料,某化学兴趣小组在实验探究Ti、Mg、Cu的活动性顺序,他们取大小相同的三种金属片,分别投入足量的稀盐酸中,观察现象如下:下列正确选项为( )
| 金属 | Ti | Mg | Cu |
| 金属表面现象 | 放出气泡速度缓慢 | 放出气泡速度快 | 无变化 |
| A、根据金属表面的现象判断三种金属的活动性为:Mg>Ti>Cu |
| B、若Ti粉中混有Mg,提纯Ti时可用稀盐酸除去Mg |
| C、用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径 |
| D、Ti和Mg的活动性比Cu强 |
下列图示的实验操作正确的是( )
A、 倾倒液体 |
B、 测溶液的pH |
C、 稀释浓硫酸 |
D、 过滤 |
 人体缺乏维生素C(简写Vc)就会患坏血病.如图为某种“维生素C”说明书的一部分,请回答:
人体缺乏维生素C(简写Vc)就会患坏血病.如图为某种“维生素C”说明书的一部分,请回答: