题目内容
(4分)下图是硫燃烧的实验装置。

(1)硫在空气中燃烧不如在氧气中燃烧剧烈的原因是
氢氧化钠溶液所起的作用是(用化学方程式表示)。__ _
(2)观察到实验现象后,为尽量减少二氧化硫逸散到空气中,
要使燃烧的硫立即熄灭。采用的措施是把燃烧匙立即伸入
氢氧化钠溶液中使火焰熄灭,依据的灭火原理____ __
(1) 空气中氧气含量 没有氧气中高;SO2+2NaOH=Na2SO3+H2O;
(2) 隔绝空气,降低温度,低于可燃物的着火点
【解析】(1)空气中氧气只占空气体积的21%,其浓度比纯氧中浓度低,故硫在空气中燃烧不如在氧气中剧烈,集气瓶底部氢氧化钠溶液的作用是吸收生成的二氧化硫,防止污染空气;
(2)灭火的方法有降低温度到可燃物的着火点以下,隔绝氧气,撤离可燃物,此实验过程中可将燃着的硫立即伸入氢氧化钠溶液中是为了降低温度至硫的着火点以下以及隔绝空气.

某校化学兴趣小组就空气中氧气的含量进行实验探究:
【集体讨论】:
(1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其它成分反应,而且生成物为固体。他们应该选择(填编号) 为了充分消耗容器中的氧气,药品的用量应保证 。
A.蜡烛 B.红磷 C.硫粉
(2)小组同学共同设计了如下图的两套装置, 你认为合理的是(填编号) 。
为了确保实验的成功,在装药品之前应该 。
【分组实验】 在讨论的基础上,他们分组进行了实验。
【数据分析】 实验结束后,整理数据如下:(注:集气瓶容积为100mL)
| 组 别 | 1 | 2 | 3 | 4 | 5 | 6 |
| 进入集气瓶中水的体积(mL) | 20 | 21 | 19 | 20 | 22 | 18 |
(3)通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的 。
通过实验还可以推断集气瓶中剩余气体的物理性质是
化学性质是 。
【实验拓展】
(4)小组的同学做完实验后又尝试用木炭重新做了以上实验,发现水几乎没有进入集气瓶。经讨论,小组的同学反思上述实验的探究过程后认为:用燃烧法测定空气中氧气含量的实验时,在药品的选择或生成物的要求上应考虑的是(答一条)________________ 。
(5)某校研究性学习小组用右下图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%。
①右图A仪器的名称是 ,燃烧、冷却后打开止水夹,水能进入集气瓶的原因是 。
②如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的 %。现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中有氮气。
【发现问题】氮气是怎样减少的呢?
【假设一】氮气与镁条反应而减少。
【假设二】 。
【查阅资料】镁条在氮气中能燃烧,产物为氮化镁固体。
该反应的文字表达式______ 。
镁条还可以在二氧化碳气体中燃烧生成碳和氧化镁,该反应文字表达式为________
。


根据下图回答问题。
 |
(1)仪器a的名称是 。
(2)实验室制取二氧化碳所选用的发生装置是 (填装置序号,下同),不选择装置E收集二氧化碳的原因是______________________。
(3)实验室用高锰酸钾制取氧气反应的化学方程式是 _____________________ ,
所选用的收集装置是E或 。主要的实验步骤有:①加热 ②装药品并固定
试管 ③检查装置的气密性 ④用排水法收集氧气 ⑤停止加热 ⑥将导管从水
槽中取出。正确的操作顺序是 _____________ (用序号表示)。
(1)酒精灯(2)B 二氧化碳能溶于水且与水反应(只答一点给分)
|
32.(5分)32.(5分)某化学小组测定空气中氧气的体积分数。
 (1)根据右图回答问题。
(1)根据右图回答问题。
①红磷燃烧的化学方程式为__________________________________。
②若将红磷改为木炭,反应结束后降至室温,打开止水夹,烧杯
中的水不倒吸入集气瓶的原因是______________________________
 _______________________________________________。
_______________________________________________。
(2)用四硫化钠(Na2S4)固体可替代红磷测定空气中氧气的体积分数。
反应原理为:2Na2S4+O2+2H2O 8S↓+4NaOH(氢氧化钠)。
小资料:四硫化钠(Na2S4)与氧气、水反应生成难溶于水的固体硫(S)和易溶于水
的氢氧化钠。
【实验过程】
①取足量的四硫化钠固体加入试管中,再加入适量的水,迅速塞紧橡胶塞,充分振荡。测量液面至橡胶塞下沿的距离,记录数据h1(如图1所示)。

图1 图2
②将该试管插入水中(如图2所示),拔下橡胶塞,观察到__________,塞紧橡胶塞。将试管取出,倒转过来,测量液面至橡胶塞下沿的距离,记录数据h2。理论上h2∶h1= 。
③按照①和② 再重复实验2次。3次实验数据如下表所示。
再重复实验2次。3次实验数据如下表所示。
| 第1次 | 第2次 | 第3次 | |
| h1/cm | 11.0 | 11.4 | 11.6 |
| h2/cm | 8.7 | 9.1 | 9.2 |
根据第3次实验数据,计算空气中氧气的体积分数为 %(结果精确到 0.1%)。
(1)①4P + 5O 2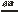 2P2O5
2P2O5
② 因为木炭燃烧生成二氧化碳气体,集气瓶内气体体积不变,瓶内气体压强没有明显变
因为木炭燃烧生成二氧化碳气体,集气瓶内气体体积不变,瓶内气体压强没有明显变
化,所以,当打开止水夹时水不会吸入到集气瓶中。
(2)②试管内液面上升至液面高度不再改变 79∶100(或4∶5)  ③ 20.7
③ 20.7
33.(8分)某兴趣小组同学阅读课外资料得知:很多因素都能影响过氧化氢分解速度。于是,
同学们探究影响过氧化氢分解速度的某种因素。
【实验过程】实验数据记录如下:
| 过氧化氢溶液的质量 | 过氧化氢溶液的浓度 | MnO2的质量 | 测量数据 | |
| Ⅰ | 50.0g | 1% | 0.1g | 9 mL |
| Ⅱ | 50.0g | 2% | 0.1g | 16 mL |
| Ⅲ | 50.0g | 4% | 0.1g | 31 mL |
【实验分析】
(1)过氧化氢分解的化学方程式为______________________________________。
(2)表格中的“测量数据”的指的是:相同时间内_________________________________。
(3)本实验中,测量O2体积的装置是________(填编号)。
 |
【实验结论】
在相同条件下______________________________________________。
【交流评价】
(1)甲同学提出在上述实验中测量______________同样能得出相同的结论。
 (2)乙同学提出用右图装置进行实验,通过比较_____________
(2)乙同学提出用右图装置进行实验,通过比较_____________
___________________也能达到实验目的。
【实验反思】
除了上述因素会影响过氧化氢分解速度外, ___________(写
一种)也会影响过氧化氢分解速度,你的实验方案是______________________________________________________________________。






