题目内容
一定质量的锌粒与某稀硫酸恰好反应,生成0.4克氢气,同时得到112.4克溶液,求:
(1)锌粒的质量.
(2)稀硫酸的溶质质量分数.
解:设锌粒的质量是Xg,纯硫酸的质量是Yg.
Zn+H2SO4═ZnSO4+H2↑
65 98 2
X Y 0.4
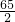 ═
═
X=13
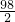 ═
═
Y=19.6
∵原硫酸溶液的质量等于112.4+0.4-13=99.8g.
∴稀硫酸的溶质的质量分数等于 ×100%═19.7%.
×100%═19.7%.
答:锌粒的质量是13g,稀硫酸的溶质的质量分数为19.7%.
分析:写出化学方程式并把数据代入计算即可得出答案.
点评:掌握化学方程式的计算方法和规范性,注意:硫酸溶液的质量的计算.
Zn+H2SO4═ZnSO4+H2↑
65 98 2
X Y 0.4
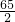 ═
═
X=13
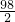 ═
═
Y=19.6
∵原硫酸溶液的质量等于112.4+0.4-13=99.8g.
∴稀硫酸的溶质的质量分数等于
 ×100%═19.7%.
×100%═19.7%.答:锌粒的质量是13g,稀硫酸的溶质的质量分数为19.7%.
分析:写出化学方程式并把数据代入计算即可得出答案.
点评:掌握化学方程式的计算方法和规范性,注意:硫酸溶液的质量的计算.

练习册系列答案
相关题目
