题目内容
t℃时,120g某KNO3溶液若蒸发去17.5g水并恢复到t℃,析出2.5g KNO3,若原溶液蒸发去27.5g水并恢复到t℃时,则析出5g KNO3,由此判断下列说法正确的是
- A.原溶液的浓度为20%
- B.蒸发后溶液的浓度为25%
- C.t℃时KNO3的溶解度为25g
- D.原溶液中硝酸钾的质量为20g
C
分析:根据溶解度的概念分析即可,溶解度:在一定温度下,某固体物质在100g溶剂里达到饱和状态时所能溶解的溶质质量.
本题关键是要找出饱和体系,根据题意前后两次各蒸发17.5g水、27.5g水,但析出的晶体质量不成比例,说明原来溶液不是饱和溶液;根据两次溶剂和溶质的质量差即可求得溶液的溶解度;若要求得原溶液中硝酸钾的质量分数关键是求得溶质硝酸钾的质量,若能求得蒸发17.5g水,析出硝酸钾晶体2.5g后剩余溶液中溶质的质量即可求出120克溶液中所含溶质的质量;再根据溶质质量即可求得原溶液和蒸发后溶液的溶质质量分数.
解答:第一蒸发掉17.5g水,析出硝酸钾晶体2.5g,另一份蒸发27.5g水,析出硝酸钾晶体5g;
则蒸发27.5g-17.5g=10g水时为饱和溶液且析出晶体质量为5g-2.5g=2.5g;
设t℃时硝酸钾的溶解度为x 则 =
=
解得:x=25g;
则t℃时硝酸钾的溶解度为25g;
故C选项正确;
120g某硝酸钾溶液蒸发去17.5g水析出2.5g硝酸钾后剩余的溶液变成饱和溶液,
则设蒸发17.5g水析出2.5g硝酸钾后剩余溶液中溶质的质量为y,
则 =
=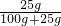
解得:y=20g;
蒸发后剩余硝酸钾溶液中溶质质量分数为: ×100%=20%;
×100%=20%;
则原溶液中硝酸钾的质量为20g+2.5g=22.5g;
原溶液中硝酸钾的质量分数是: ×100%=18.75%;
×100%=18.75%;
故A、B、D错误;
故选C.
点评:解答本题的关键是找出硝酸钾溶液的溶解度;理解溶解度的概念包括四个要素:①指明一定温度;②溶剂为100g;③必须达到饱和状态;④单位为g.
分析:根据溶解度的概念分析即可,溶解度:在一定温度下,某固体物质在100g溶剂里达到饱和状态时所能溶解的溶质质量.
本题关键是要找出饱和体系,根据题意前后两次各蒸发17.5g水、27.5g水,但析出的晶体质量不成比例,说明原来溶液不是饱和溶液;根据两次溶剂和溶质的质量差即可求得溶液的溶解度;若要求得原溶液中硝酸钾的质量分数关键是求得溶质硝酸钾的质量,若能求得蒸发17.5g水,析出硝酸钾晶体2.5g后剩余溶液中溶质的质量即可求出120克溶液中所含溶质的质量;再根据溶质质量即可求得原溶液和蒸发后溶液的溶质质量分数.
解答:第一蒸发掉17.5g水,析出硝酸钾晶体2.5g,另一份蒸发27.5g水,析出硝酸钾晶体5g;
则蒸发27.5g-17.5g=10g水时为饱和溶液且析出晶体质量为5g-2.5g=2.5g;
设t℃时硝酸钾的溶解度为x 则
 =
=
解得:x=25g;
则t℃时硝酸钾的溶解度为25g;
故C选项正确;
120g某硝酸钾溶液蒸发去17.5g水析出2.5g硝酸钾后剩余的溶液变成饱和溶液,
则设蒸发17.5g水析出2.5g硝酸钾后剩余溶液中溶质的质量为y,
则
 =
=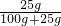
解得:y=20g;
蒸发后剩余硝酸钾溶液中溶质质量分数为:
 ×100%=20%;
×100%=20%;则原溶液中硝酸钾的质量为20g+2.5g=22.5g;
原溶液中硝酸钾的质量分数是:
 ×100%=18.75%;
×100%=18.75%;故A、B、D错误;
故选C.
点评:解答本题的关键是找出硝酸钾溶液的溶解度;理解溶解度的概念包括四个要素:①指明一定温度;②溶剂为100g;③必须达到饱和状态;④单位为g.

练习册系列答案
相关题目
下表列出了一定温度和压强下每立方厘米活性炭所能吸附的常见气体的体积:
| 气 体 | 二氧化碳 | 氢气 | 氧气 | 氮气 | 氯气 |
| 相对分子质量 | 44 | 2 | 32 | 28 | 71 |
| 沸 点/℃ | -78 | -252 | -183 | -196 | -34 |
| 被吸附体积/mL | 97 | 4.5 | 35 | 11 | 494 |
(1)________;
(2)________.
小明在家里帮妈妈生蜂窝煤炉时,对观察的一些现象进行了思考,但是有很多问题无法解决,请你用所学的知识来帮助小明完成下面的表格.
| 小明的观察 | 依据原理或解释 |
| (1)妈妈让他先用火柴点燃报纸,再引燃木柴,最后再放上蜂窝煤 | |
| (2)小明记得以前用的是散煤,现在改用蜂窝煤 | |
| (3)邻居家生炉子时,在进气口处放置了鼓风机 |
