题目内容
某学生用足量的一氧化碳还原10g赤铁矿石(主要成分为氧化铁,所含杂质为不参加反应的固体物质),充分反应后,称量剩余固体质量为7.6g,
请回答下列问题:
(1)氧化铁中铁元素的质量分数为 ;
(2)计算赤铁矿石中氧化铁的质量,写出一氧化碳还原氧化铁反应的化学方程式和必要的计算过程.
请回答下列问题:
(1)氧化铁中铁元素的质量分数为
(2)计算赤铁矿石中氧化铁的质量,写出一氧化碳还原氧化铁反应的化学方程式和必要的计算过程.
分析:(1)根据氧化铁的化学式和相对原子质量可以计算铁元素的质量分数;
(2)可以假设赤铁矿中氧化铁的质量为x,则赤铁矿中杂质的质量为:10g-x,反应后生成铁的质量为:7.6g-(10g-x),再根据反应的化学方程式可以计算氧化铁的质量.
(2)可以假设赤铁矿中氧化铁的质量为x,则赤铁矿中杂质的质量为:10g-x,反应后生成铁的质量为:7.6g-(10g-x),再根据反应的化学方程式可以计算氧化铁的质量.
解答:解:(1)氧化铁的化学式是Fe2O3,其中铁元素的质量分数为:
×100%=70%;
故填:70%.
(2)解:设赤铁矿石中氧化铁的质量为x,
Fe2O3+3CO
2Fe+3CO2,固体△m
160 112 48
x 10g-7.6g
=
,
x=8g,
答:赤铁矿石中氧化铁的质量为8g.
| 56×2 |
| 56×2+16×3 |
故填:70%.
(2)解:设赤铁矿石中氧化铁的质量为x,
Fe2O3+3CO
| ||
160 112 48
x 10g-7.6g
| 160 |
| 48 |
| x |
| 10g-7.6g |
x=8g,
答:赤铁矿石中氧化铁的质量为8g.
点评:解答本题的关键是反应前后杂质的质量不变,以此为基础可以列出比例式,从而求出氧化铁的质量.

练习册系列答案
相关题目
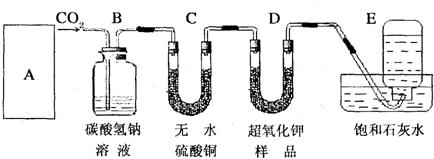
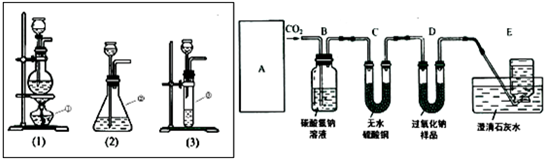
 25、超氧化钾(KO2)是一种黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用它作制氧剂,供人们呼吸之用,它与二氧化碳反应的化学方程式为:4KO2+2CO2═2K2CO3+3O2,某学生为了验证这一实验,以大理石,足量的盐酸和超氧化钾为原料制取O2,设计如下实验装置:
25、超氧化钾(KO2)是一种黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用它作制氧剂,供人们呼吸之用,它与二氧化碳反应的化学方程式为:4KO2+2CO2═2K2CO3+3O2,某学生为了验证这一实验,以大理石,足量的盐酸和超氧化钾为原料制取O2,设计如下实验装置: