题目内容
为测定某石灰石样品中CaCO3的质量分数,取该样品6.0g,装入烧杯中,加入36.5g稀盐酸,恰好完全反应(样品中的杂质不溶于水且不与盐酸反应).反应后过滤,得不饱和CaCl2溶液39.3g.(假设操作过程中溶液无损失)
试计算:①样品中CaCO3的质量分数. ②稀盐酸中溶质的质量分数.
试计算:①样品中CaCO3的质量分数. ②稀盐酸中溶质的质量分数.
(1)设样品中CaCO3质量为x
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 73 44
x
依题意:x+36.5g=39.3g+
,x=5.0g
CaCO3的质量分数:
×100%=83%
(2)稀盐酸中溶质的质量分数:
×100%=10%
答:样品中CaCO3的质量分数为83%;稀盐酸中溶质的质量分数是10%.
故答案为:①83%;②10%.
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 73 44
x
| 73x |
| 100 |
| 44x |
| 100 |
依题意:x+36.5g=39.3g+
| 44x |
| 100 |
CaCO3的质量分数:
| 5.0g |
| 6.0g |
(2)稀盐酸中溶质的质量分数:
| 73×5.0g/100 |
| 36.5g |
答:样品中CaCO3的质量分数为83%;稀盐酸中溶质的质量分数是10%.
故答案为:①83%;②10%.

练习册系列答案
相关题目
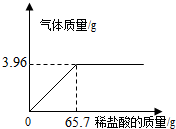 课题小组为测定某石灰石样品中CaCO3的含量,取l0g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容:
课题小组为测定某石灰石样品中CaCO3的含量,取l0g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容: