题目内容
为了测定铜锌合金粉末中铜的质量分数,某兴趣小组的同学设计了不同的方案进行实验:

甲同学的实验方案
①按图1组装好装置,并称得装置的质量为a g.
②取下锥形瓶上的橡皮塞,向锥形瓶中加入b g铜锌合金粉末,再加入足量的稀盐酸,立即塞紧橡皮塞.
③待充分反应后,称得装置和装置中物质的总质量为c g.
④计算铜锌合金中铜的质量分数.
乙同学的实验方案
①按图2组装好装置.
②取下烧瓶上的橡皮塞,向锥形瓶中加入1.0g铜锌合金粉末,塞紧橡皮塞.
③通过分液漏斗向烧瓶中加入10.0mL稀硫酸(足量),立即关闭分液漏斗活塞.
④待充分反应后,测得进入量筒的水的体积为122.0mL.
⑤计算铜锌合金中铜的质量分数.
回答下列问题:
(1)锥形瓶中发生的反应属于
(2)甲同学若要计算出样品中铜的质量分数,还需要测得的数据是
A.碱石灰的质量 B.加入的稀盐酸的质量 C.稀盐酸中溶质的质量分数
(3)在甲同学实验后,丙同学过滤锥形瓶中的物质,洗涤、干燥滤渣,称得滤渣质量为d g.
丙同学测得铜锌合金中铜的质量分数为
×100%
×100%.
(4)为减少实验误差,在乙同学的实验步骤①和②之间还需要增加的实验操作是--,这样能保证实验称量结果的准确性.已知该温度下氢气的密度为0.09g/L,则乙同学测得的铜锌合金中铜的质量分数为

甲同学的实验方案
①按图1组装好装置,并称得装置的质量为a g.
②取下锥形瓶上的橡皮塞,向锥形瓶中加入b g铜锌合金粉末,再加入足量的稀盐酸,立即塞紧橡皮塞.
③待充分反应后,称得装置和装置中物质的总质量为c g.
④计算铜锌合金中铜的质量分数.
乙同学的实验方案
①按图2组装好装置.
②取下烧瓶上的橡皮塞,向锥形瓶中加入1.0g铜锌合金粉末,塞紧橡皮塞.
③通过分液漏斗向烧瓶中加入10.0mL稀硫酸(足量),立即关闭分液漏斗活塞.
④待充分反应后,测得进入量筒的水的体积为122.0mL.
⑤计算铜锌合金中铜的质量分数.
回答下列问题:
(1)锥形瓶中发生的反应属于
置换反应
置换反应
(填基本反应类型).图1装置中碱石灰的作用是吸收水蒸气和氯化氢气体
吸收水蒸气和氯化氢气体
.(2)甲同学若要计算出样品中铜的质量分数,还需要测得的数据是
B
B
.(填标号)A.碱石灰的质量 B.加入的稀盐酸的质量 C.稀盐酸中溶质的质量分数
(3)在甲同学实验后,丙同学过滤锥形瓶中的物质,洗涤、干燥滤渣,称得滤渣质量为d g.
丙同学测得铜锌合金中铜的质量分数为
| d g |
| b g |
| d g |
| b g |
(4)为减少实验误差,在乙同学的实验步骤①和②之间还需要增加的实验操作是--,这样能保证实验称量结果的准确性.已知该温度下氢气的密度为0.09g/L,则乙同学测得的铜锌合金中铜的质量分数为
67.5%
67.5%
.分析:(1)根据锌与稀盐酸的反应特点和反应类型分析解答,碱石灰的作用是吸收水蒸气和氯化氢气体;
(2)根据质量守恒定律,反应物的质量=生成物的质量进行分析解答;
(3)根据铜排在顺序表中氢的后面,与稀硫酸不反应,所以得到的滤渣就是铜的质量,再根据混合物中某物质的质量分数的计算法进行计算;
(4)乙同学要测生成氢气的体积,则需要检查装置的气密性,以防出现误差,并根据锌与盐酸反应的方程式计算求解.
(2)根据质量守恒定律,反应物的质量=生成物的质量进行分析解答;
(3)根据铜排在顺序表中氢的后面,与稀硫酸不反应,所以得到的滤渣就是铜的质量,再根据混合物中某物质的质量分数的计算法进行计算;
(4)乙同学要测生成氢气的体积,则需要检查装置的气密性,以防出现误差,并根据锌与盐酸反应的方程式计算求解.
解答:解:(1)锌与稀盐酸的反应生成氯化锌和氢气,由一种单质和一种化合物反应生成另一种单质和化合物,符合置换反应特点,属于置换反应,碱石灰的作用是吸收水蒸气和氯化氢气体,从而使计算结果准确,否则造成氢气的质量偏大,则使锌的质量偏大,铜的质量分数偏小;
故答案为:
置换;吸收水蒸气和氯化氢气体;
(2)根据质量守恒定律,反应物的质量=生成物的质量,要计算生成氢气的质量,分析题意,还需要知道加入的稀盐酸的质量;
故选B;
(3)铜排在顺序表中氢的后面,与稀硫酸不反应,所以得到的滤渣就是铜的质量,所以混合物中铜的质量分数是
×100%=
%;
故答案为:
%;
(4)乙同学要测生成氢气的体积,则需要检查装置的气密性,以防出现误差;
根据题意,得到氢气的质量是0.09g/L×0.122L=0.01g
设反应的锌的质量是X
Zn+2HCl=ZnCl2+H2↑
65 2
X 0.01g
=
X=0.325g
∴合金中铜的质量=1.0g-0.325g=0.675g
则铜的质量分数为:
×100%=67.5%
故答案为:
检查装置气密性; 67.5%.
故答案为:
置换;吸收水蒸气和氯化氢气体;
(2)根据质量守恒定律,反应物的质量=生成物的质量,要计算生成氢气的质量,分析题意,还需要知道加入的稀盐酸的质量;
故选B;
(3)铜排在顺序表中氢的后面,与稀硫酸不反应,所以得到的滤渣就是铜的质量,所以混合物中铜的质量分数是
| d g |
| b g |
| 100d |
| b |
故答案为:
| 100d |
| b |
(4)乙同学要测生成氢气的体积,则需要检查装置的气密性,以防出现误差;
根据题意,得到氢气的质量是0.09g/L×0.122L=0.01g
设反应的锌的质量是X
Zn+2HCl=ZnCl2+H2↑
65 2
X 0.01g
| 65 |
| X |
| 2 |
| 0.01g |
X=0.325g
∴合金中铜的质量=1.0g-0.325g=0.675g
则铜的质量分数为:
| 0.675g |
| 1.0g |
故答案为:
检查装置气密性; 67.5%.
点评:解题时,首先明确实验目的,分析题目中所涉及的反应原理和方法,并结合相关知识细心分析解答.

练习册系列答案
相关题目
a、常熟白雪冰箱厂新购进了一批黄铜(铜锌合金).为了测定这批黄铜中铜的质量分数,化验人员将取来的样品先加工成粉未,然后利用该粉末与稀硫酸在烧杯内发生反应.在所进行的三次实验中,只有一次所取用的稀硫酸与黄铜样品是恰好完全反应的.有关实验数据记录如下:
请分析实验数据,完成下列问题:
(1)黄铜样品与稀硫酸恰好完全反应时两种物质的质量之比为 ,该黄铜样品中铜的质量分数为 .
(2)计算黄铜样品与稀硫酸恰好完全反应后所得的溶液中溶质的质量分数.(计算结果精确到0.1%)
b、课题小组为测定某石灰石样品中CaCO3的含量,取10g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容:
(1)样品中CaCO3的含量是多少?
(2)所用稀盐酸的质量分数是多少?
我解答 小题(请在横线上填写题号“a”或“b”,以确认你的选择).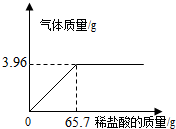
| 实验次数 | 1 | 2 | 3 |
| 所取黄铜样品的质量/g | 10.0 | 10.0 | 20.0 |
| 加入稀硫酸的质量/g | 100.0 | 80.0 | 80.0 |
| 反应后烧杯内剩余物质的质量/g | 109.8 | 89.8 | 99.8 |
(1)黄铜样品与稀硫酸恰好完全反应时两种物质的质量之比为
(2)计算黄铜样品与稀硫酸恰好完全反应后所得的溶液中溶质的质量分数.(计算结果精确到0.1%)
b、课题小组为测定某石灰石样品中CaCO3的含量,取10g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容:
(1)样品中CaCO3的含量是多少?
(2)所用稀盐酸的质量分数是多少?
我解答




