题目内容
17.下列因素不会造成空气污染的是( )| A. | 煤的燃烧 | B. | 石油的燃烧 | C. | 二氧化碳的排放 | D. | 植物的光合作用 |
分析 造成对空气污染的有害物质大致可分为:粉尘和有害气体两大类.从世界范围看,排放到空气中的有害气体主要有二氧化硫、一氧化碳,氮的氧化物等.由选项中变化生成的物质确定是否造成空气污染.
解答 解:A、煤的燃烧会产生二氧化硫、二氧化氮、一氧化碳等空气污染物,会造成空气污染,故选项错误.
B、石油的燃烧会产生二氧化硫、二氧化氮、一氧化碳等空气污染物,会造成空气污染,故选项错误.
C、二氧化碳不是空气污染物,不会造成空气污染,故选项正确.
D、植物的光合作用吸收二氧化碳,释放出氧气,不会造成空气污染,故选项正确.
故选:CD.
点评 环保问题是人们关注的热点,也是中考的热点,了解空气污染原因、来源即可正确解答本题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.配制10%的氯化钠溶液时,不会引起溶液中氯化钠的质量分数偏小的是( )
| A. | 用量筒量取水时仰视读数 | |
| B. | 称量时所用的砝码缺损一角 | |
| C. | 氯化钠晶体不纯 | |
| D. | 转移已配好的溶液时,烧杯中有剩余残液 |
8.如图所示的化学实验基本操作中,正确的是( )
| A. |  | B. |  | C. |  | D. |  |
5.苏美联军在伊拉克战场上使用的炸弹中含有铀-238原料,这种铀原子的相同时对原子质量为238,质子数为92,则它的中子数与电子数之差为( )
| A. | 54 | B. | 146 | C. | 238 | D. | 330 |
9.化学方程式 S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 可读作( )
| A. | 硫加氧等于二氧化硫 | |
| B. | 硫加氧气点燃后生成二氧化硫 | |
| C. | 硫和氧气点燃生成二氧化硫 | |
| D. | 一个硫和一个氧点燃后生成一个二氧化硫 |
7.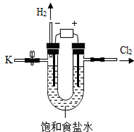 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实
某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实
验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
老师提示:I.电解饱和食盐水的化学方程式:
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
II.忽略其他可能发生的反应对以下实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
探究活动二:测定待测液中氢氧化钠的质量分数
【实验1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加入一定溶质质量分数的稀盐酸,边加边振荡,用pH计测定溶液的pH,数据如下:
(2)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据,计算所称取待测液中氢氧化钠的质量,应从选用稀盐酸的体积为9.8mL.
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液中发生反应:
2NaOH+MgCl2=Mg(OH)2↓+2NaCl
乙组同学按如图所示的实验步骤进行实验:
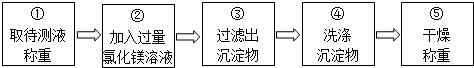
(3)步骤②加入的氯化镁溶液必需足量或过量,其目的是使氢氧化钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否过量的具体操作:静置,取上层清液与试管中,滴加氢氧化钠溶液,产生白色沉淀,说明氯化镁溶液已经过量(写出实验步骤、现象和结论).
(4)步骤③过滤出的沉淀物是氢氧化镁.
(5)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实
某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
老师提示:I.电解饱和食盐水的化学方程式:
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
II.忽略其他可能发生的反应对以下实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量待测液于试管中,滴加几滴无色酚酞试液 | 酚酞试液变红色 | 待测液呈碱性,表明含有氢氧化钠 |
【实验1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加入一定溶质质量分数的稀盐酸,边加边振荡,用pH计测定溶液的pH,数据如下:
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 |
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液中发生反应:
2NaOH+MgCl2=Mg(OH)2↓+2NaCl
乙组同学按如图所示的实验步骤进行实验:

(3)步骤②加入的氯化镁溶液必需足量或过量,其目的是使氢氧化钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否过量的具体操作:静置,取上层清液与试管中,滴加氢氧化钠溶液,产生白色沉淀,说明氯化镁溶液已经过量(写出实验步骤、现象和结论).
(4)步骤③过滤出的沉淀物是氢氧化镁.
(5)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).

 图是电解水的实验装置,据图回答
图是电解水的实验装置,据图回答