题目内容
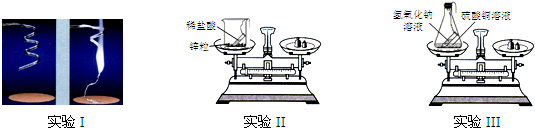
某课外兴趣小组的同学为了探究金属的活动性顺序,设计并完成了下图所示实验:
请你根据他们所做的实验回答:
(1)实验③中,硫酸的质量分数W%应为______.
(2)通过上述实验,你得出上述三种金属活动性顺序是:______.
(3)上述实验是否合理地验证了铁、铜、银的活动性?______(填“合理”、“不合理”).若不合理,请你把实验补充完整(在右图横线上填上所需物质)若合理,则不需要填写.
| 实验 |  ① |
 ② |
 ③ |
| 实验现象 | 铜片表面无明显变化 | 银片表面无明显 变化 |
铁片表面有无色气泡产生,溶液最终变为浅绿色 |
(1)实验③中,硫酸的质量分数W%应为______.
(2)通过上述实验,你得出上述三种金属活动性顺序是:______.
(3)上述实验是否合理地验证了铁、铜、银的活动性?______(填“合理”、“不合理”).若不合理,请你把实验补充完整(在右图横线上填上所需物质)若合理,则不需要填写.

(1)要比较金属的活动性顺序,变量只能是金属,其它量都要控制相同,所以实验③中,硫酸的质量分数W%应为5%
(2)实验①②③的现象要吧说明铁能与硫酸反应,而铜和银与硫酸不反应,故金属活动性顺序为Fe>Cu、Fe>Ag
(3)上述实验只能验证了铁、铜、银的活动性顺序,不能比较铜和银的活动性,故不合理,还应将铜放入硝酸银溶液中,看是否能发生反应.
故答案为:
(1)5%;
(2)Fe>Cu、Fe>Ag;
(3)不合理;铜、硝酸银.
(2)实验①②③的现象要吧说明铁能与硫酸反应,而铜和银与硫酸不反应,故金属活动性顺序为Fe>Cu、Fe>Ag
(3)上述实验只能验证了铁、铜、银的活动性顺序,不能比较铜和银的活动性,故不合理,还应将铜放入硝酸银溶液中,看是否能发生反应.
故答案为:
(1)5%;
(2)Fe>Cu、Fe>Ag;
(3)不合理;铜、硝酸银.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目


 某课外兴趣小组的同学所做的下列四个实验,符合如图所示图象的是( )
某课外兴趣小组的同学所做的下列四个实验,符合如图所示图象的是( )