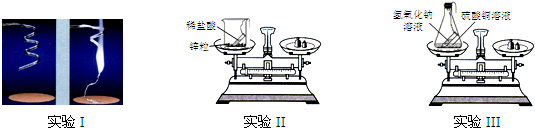
题目内容
 某课外兴趣小组的同学所做的下列四个实验,符合如图所示图象的是( )
某课外兴趣小组的同学所做的下列四个实验,符合如图所示图象的是( )分析:从图象看一开始不产生沉淀或气体,反应一段时间后产生沉淀或气体再结合以下反应分析.
A、根据铜和稀盐酸不反应,锌和稀盐酸反应生成氢气,并且一开始就反应产生氢气分析.
B、根据氢氧化钡和稀硫酸反应生成硫酸钡白色沉淀和水,一开始就产生沉淀;硝酸钠和稀硫酸不反应分析.
C、根据氯化钠和硝酸银一接触就反应生成氯化银白色沉淀和硝酸钠分析.
D、根据氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,稀盐酸和氢氧化钠反应生成氯化钠和水,氢氧化铁和稀盐酸反应生成氯化铁和水三个反应分析.
A、根据铜和稀盐酸不反应,锌和稀盐酸反应生成氢气,并且一开始就反应产生氢气分析.
B、根据氢氧化钡和稀硫酸反应生成硫酸钡白色沉淀和水,一开始就产生沉淀;硝酸钠和稀硫酸不反应分析.
C、根据氯化钠和硝酸银一接触就反应生成氯化银白色沉淀和硝酸钠分析.
D、根据氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,稀盐酸和氢氧化钠反应生成氯化钠和水,氢氧化铁和稀盐酸反应生成氯化铁和水三个反应分析.
解答:解:A、在稀盐酸中加入适量的铜锌合金,铜和稀盐酸不反应,锌和稀盐酸反应生成氢气,并且一开始就反应产生氢气,A不符合.
B、铜和稀盐酸不反应,锌和稀盐酸反应生成氢气,并且一开始就反应产生氢气,B不符合.
C、氯化钠和硝酸银一接触就反应生成氯化银白色沉淀和硝酸钠,C不符合.
D、氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,稀盐酸和氢氧化钠反应生成氯化钠和水,但氢氧化铁和稀盐酸反应生成氯化铁和水,所以相当于稀盐酸先和氢氧化钠反应生成氯化钠和水,稀盐酸全反应后氯化铁才和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,D符合.
故选D.
B、铜和稀盐酸不反应,锌和稀盐酸反应生成氢气,并且一开始就反应产生氢气,B不符合.
C、氯化钠和硝酸银一接触就反应生成氯化银白色沉淀和硝酸钠,C不符合.
D、氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,稀盐酸和氢氧化钠反应生成氯化钠和水,但氢氧化铁和稀盐酸反应生成氯化铁和水,所以相当于稀盐酸先和氢氧化钠反应生成氯化钠和水,稀盐酸全反应后氯化铁才和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,D符合.
故选D.
点评:分析清楚图象上转折点的意义是解答该题的关键,再就是要熟练掌握酸碱盐之间的反应.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目