题目内容
9.(1)锂是一种金属单质,化学式Li,锂原子结构示意图为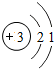 ,易失去最外层一个电子.则锂的氧化物的化学式为Li2O.
,易失去最外层一个电子.则锂的氧化物的化学式为Li2O.(2)“绿色化学”强调采取有效措施防止对环境的破坏和污染.在汽车排气管上装一个“催化转换器”,可使汽车尾气中的NO和CO反应,生成能参与大气生态循环的两种无毒气体.NO与CO反应的化学方程式为2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2 .
(3)工业酒精中常含有少量甲醇.甲醇有毒,易挥发.请你根据甲醇在氧气中完全燃烧的产物是CO2和H2O,推断甲醇肯定含有C、H元素,还可能含有O元素.
分析 (1)在形成化合物时,锂易失去最外层一个电子,故化合价表现为+1价,而氧元素为-2价,故锂的氧化物的化学式为Li2O;
(2)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可;
(3)根据质量守恒定律可知反应前后各元素的种类不变考虑.
解答 解:(1)由锂原子结构示意图为 可知,在形成化合物时,锂易失去最外层一个电子,故化合价表现为+1价,而氧元素为-2价,故锂的氧化物的化学式为Li2O.故答案为:Li2O;
可知,在形成化合物时,锂易失去最外层一个电子,故化合价表现为+1价,而氧元素为-2价,故锂的氧化物的化学式为Li2O.故答案为:Li2O;
(2)CO与NO反应,生成可参与大气生态环境循环的无毒气体.根据空气的组成成分和质量守恒定律中元素种类不变的特点可知生成的无毒气体是二氧化碳和氮气.
因此催化转换器可使一氧化碳与一氧化氮在催化剂的催化作用下反应生成二氧化碳和氮气.该反应的化学方程式为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
故答案为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2 ;
(3)反应前后各元素的种类不变,甲醇燃烧生成二氧化碳和水,生成物中含有碳元素、氢元素、氧元素;而反应物氧气中只含有氧元素,所以甲醇中一定含有碳元素和氢元素,可能含有氧元素.
故答案为:C、H;O.
点评 此题考查根据元素的化合价会写出物质的化学式,属于基础知识的考查,解答本题关键是要知道质量守恒定律的内容,并能灵活运用解决实际问题.

练习册系列答案
相关题目
11.无土栽培是利用化学溶液(营养液)栽培作物的一门技术.营养液是多种化合物的水溶液,其中含有作物生长所需的营养元素.某种作物在进行无土栽培时,需含氮、钾等元素的中性或弱 酸性营养液,下面能用来配制营养液的是( )
| A. | KCl、(NH4)2SO4、NaOH | B. | NH4Cl、KCl、K2SO4 | ||
| C. | Na2CO3、K2CO3、Ca3(PO4)2 | D. | KHCO3、NH4NO3、HNO3 |
8.下面有关饱和溶液说法正确的是( )
| A. | 某物质的饱和溶液可能是稀溶液 | |
| B. | 升高温度,饱和溶液一定可以变为不饱和溶液 | |
| C. | 溶液达到饱和时,溶解的溶质的质量为该物质的溶解度 | |
| D. | 饱和溶液是指不能再溶解任何物质的溶液 |
4.某混合气体中可能含有氮气、氯化氢、一氧化碳中的一种或几种.将上述气体样品依次通过足量饱和碳酸氢钠溶液和灼热的氧化铜后恢复至原来的温度(室温),气体体积均无明显变化,但氧化铜部分变红.再将气体通过足量氢氧化钠溶液,气体体积减少但仍有少量气体剩余.则该混合气体的成分是( )
| A. | N2、HCl、CO | B. | N2、CO | ||
| C. | 一定有 N2、CO,可能有氯化氢 | D. | 一定有CO,可能有N2和HCl |
14. 在托盘天平两边各放一只烧杯,调节至平衡,再向两只烧杯中各注入相同质量、相同质最分数的稀硫酸,然后按如图所示分别投入相同质量的锌粒和镁带,当镁条和锌粒完全溶解后,天平指针( )
在托盘天平两边各放一只烧杯,调节至平衡,再向两只烧杯中各注入相同质量、相同质最分数的稀硫酸,然后按如图所示分别投入相同质量的锌粒和镁带,当镁条和锌粒完全溶解后,天平指针( )
 在托盘天平两边各放一只烧杯,调节至平衡,再向两只烧杯中各注入相同质量、相同质最分数的稀硫酸,然后按如图所示分别投入相同质量的锌粒和镁带,当镁条和锌粒完全溶解后,天平指针( )
在托盘天平两边各放一只烧杯,调节至平衡,再向两只烧杯中各注入相同质量、相同质最分数的稀硫酸,然后按如图所示分别投入相同质量的锌粒和镁带,当镁条和锌粒完全溶解后,天平指针( )| A. | 偏左 | B. | 偏右 | C. | 居中 | D. | 无法判断 |
1.下列实验现象的描述正确的是( )
| A. | 木炭在氧气中燃烧生成黑色固体 | |
| B. | 磷在氧气中燃烧产生大量的白雾 | |
| C. | 硫在氧气中燃烧发出蓝紫色火焰,生成有刺激性气味的气体 | |
| D. | 铁丝在氧气中剧烈燃烧,火星四射,生成四氧化三铁 |
18.下列观点不正确的是( )
| A. | 水的化学性质由水原子来保持 | |
| B. | 氯化钠是由钠离子和氯离子构成的 | |
| C. | 八月闻到桂花的香味能证明微粒是不断运动的 | |
| D. | 水和酒精混合总体积会变小说明微粒间有一定的空隙 |
19.地壳中含量最多的金属元素是( )
| A. | H | B. | O | C. | Si | D. | Al |