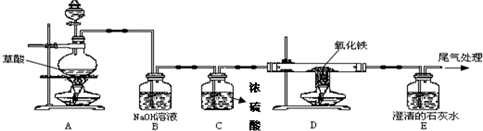
题目内容
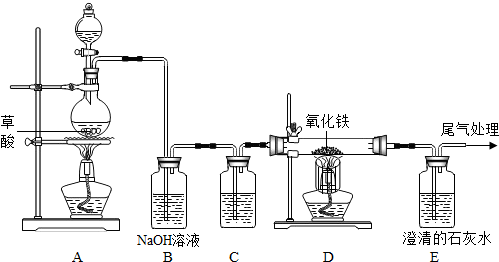
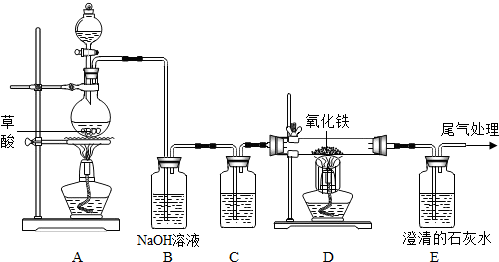
已知草酸(H2C2O4)在加热条件下的反应为H2C2O4
| ||

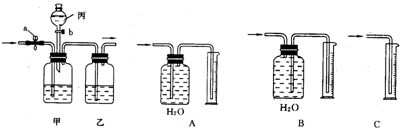
(1)甲中盛放
(2)首先,打开活塞a,让混合气体通过甲、乙装置,能分离出来的气体是
(3)要分离出另一种气体,则丙中应盛装
(4)有一名同学想测定分离出来的CO气体的体积,请帮助该同学从上图A,B,C 3个装置中选择一个合理的量气装置
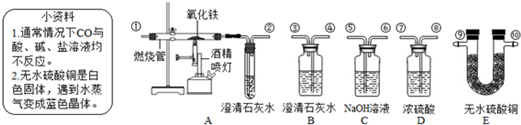
分析:(1)根据实验室常用吸收二氧化碳,干燥气体的试剂进行分析解答,
(2)根据甲装置中的试剂和甲乙装置的反应原理进行分析解答,
(3)根据甲乙分离出气体的先后顺序和需要分离气体的性质进行分析,
(4)根据一氧化碳密度比空气小和难溶于水等物理性质进行分析解答.
(2)根据甲装置中的试剂和甲乙装置的反应原理进行分析解答,
(3)根据甲乙分离出气体的先后顺序和需要分离气体的性质进行分析,
(4)根据一氧化碳密度比空气小和难溶于水等物理性质进行分析解答.
解答:解:(1)根据该题的反应原理以及一氧化碳和二氧化碳的性质,可以判断先分离出一氧化碳,再分离出二氧化碳,就需要先将二氧化碳吸收,在实验室吸收二氧化碳常采用氢氧化钠溶液,而干燥气体要用浓硫酸,故答案为:NaOH溶液或氢氧化钠溶液;浓H2SO4或浓硫酸;干燥气体.
(2)根据(1)可以知道广口瓶中盛放的是氢氧化钠,会吸收二氧化碳,而一氧化碳不会与氢氧化钠反应,将一氧化碳分离,故答案为:CO(或一氧化碳); CO2+2NaOH=Na2CO3+H2O
(3)(2)中氢氧化钠吸收了二氧化碳,分离出了一氧化碳,要将二氧化碳分离出,又不能引入新的杂质,只能用硫酸,故答案为:稀H2SO4(或稀硫酸);关闭a,打开b,让丙中溶液缓缓流下至不再产生气泡时关闭b;向上排空气;H2SO4+Na2CO3=Na2SO4+H2O+CO2↑
(4)一氧化碳的密度比空气小且难溶于水,是无色无味的气体,故答案为:B
(2)根据(1)可以知道广口瓶中盛放的是氢氧化钠,会吸收二氧化碳,而一氧化碳不会与氢氧化钠反应,将一氧化碳分离,故答案为:CO(或一氧化碳); CO2+2NaOH=Na2CO3+H2O
(3)(2)中氢氧化钠吸收了二氧化碳,分离出了一氧化碳,要将二氧化碳分离出,又不能引入新的杂质,只能用硫酸,故答案为:稀H2SO4(或稀硫酸);关闭a,打开b,让丙中溶液缓缓流下至不再产生气泡时关闭b;向上排空气;H2SO4+Na2CO3=Na2SO4+H2O+CO2↑
(4)一氧化碳的密度比空气小且难溶于水,是无色无味的气体,故答案为:B
点评:本题主要考查了利用化学的方法对一氧化碳和二氧化碳的分离,综合性强,难度较大,需要比较强的分析能力.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目