题目内容
7.海水晒得的粗盐中常含有泥沙、氯化镁、硫酸钠和氯化钙,先将固体溶解,①过滤,向滤液中依次加入过量的氢氧化钠溶液、氯化钡溶液、碳酸钠溶液,②过滤、再向滤液中加入适量的稀盐酸,蒸发结晶(1)写出过滤操作用到所有的玻璃仪器
(2)第②次过滤后溶液中的溶质有哪些?
(3)如何判断向滤液中所加的稀盐酸已经适量?
分析 (1)过滤操作用到所有的玻璃仪器是烧杯、玻璃棒和漏斗;
(2)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,和氯化钡反应生成碳酸钡沉淀和氯化钠;
(3)稀盐酸和氢氧化钠反应生成氯化钠和水,和碳酸钠反应生成氯化钠、水和二氧化碳.
解答 解:(1)过滤操作用到所有的玻璃仪器是烧杯、玻璃棒和漏斗.
故答案为:烧杯、玻璃棒和漏斗.
(2)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,和氯化钡反应生成碳酸钡沉淀和氯化钠,因此第②次过滤后溶液中的溶质有氯化钠、氢氧化钠和碳酸钠.
故答案为:氯化钠、氢氧化钠和碳酸钠.
(3)判断向滤液中所加的稀盐酸已经适量的依据是:刚好不产生气泡,这是因为此时氢氧化钠、碳酸钠和稀盐酸恰好完全反应.
故答案为:刚好不产生气泡.
点评 加入碳酸钠溶液、氢氧化钠溶液和氯化钡溶液除去杂质时,碳酸钠溶液应该在加入氯化钡溶液后再加入,否则过量的氯化钡溶液无法除去.

练习册系列答案
相关题目
9.如图是三种固体物质的溶解度曲线,下列说法正确的是( )


| A. | t2℃时,将30ga物质加入50g水中充分搅拌,得到80ga物质的饱和溶液 | |
| B. | t1℃时,a、c两种物质的饱和溶液中所含溶质质量相等 | |
| C. | 将t2℃时三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数的大小关系是:b>a=c | |
| D. | t2℃时,若要将N点的a溶液转变为M点的a溶液,可采取恒温蒸发溶剂的方法 |
12.小萱和小屏分别进行酸碱中和实验,将0.5M氢氧化钠溶液装入滴定管中,开始滴入装有0.5M、3mL盐酸和数滴酚酞指示剂的锥形瓶内,且不时摇晃锥形瓶,直到溶液颜色发生变化为止.表为过程中,氢氧化钠溶液用量的刻度和锥形瓶内溶液颜色的记录,关于二人用量不同的结果,下列叙述何者正确?( )
小萱
小屏
小萱
| NaOH(mL) | 锥形瓶内溶液颜色 |
| 0 | 无色 |
| 0.2 | 无色 |
| 0.5 | 无色 |
| 1.0 | 无色 |
| 1.5 | 无色 |
| 2.0 | 无色 |
| 4.0 | 红色 |
| NaOH(mL) | 锥形瓶内溶液颜色 |
| 0 | 无色 |
| 1.0 | 无色 |
| 2.0 | 无色 |
| 2.5 | 无色 |
| 2.7 | 无色 |
| 2.9 | 无色 |
| 3.1 | 红色 |
| A. | 小萱的结果较准确,瓶内溶液变红色代表此时溶液呈碱性 | |
| B. | 小屏的结果较准确,瓶内溶液变红色代表此时溶液呈碱性 | |
| C. | 小萱的结果较准确,接近变色范围时应逐次增加氢氧化钠滴入量 | |
| D. | 小屏的结果较准确,接近变色范围时应逐次减少氢氧化钠滴入量 |
19.工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4,为了测定铁红中铁的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析.
【资料1】草酸晶体(H2C2O4•3H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O4•3H2O$\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$CO2↑+CO↑+4H2O
【问题讨论】用如图所示装置进行实验:
(1)实验前应先检查装置的气密性.
(2)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是c、a(填字母编号)
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)B装置的作用是检验二氧化碳是否被A装置完全吸收.
(4)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前将装置中的空气排出,防止发生爆炸
②停止加热后把反应生成的二氧化碳全部排入E装置中.
【数据分析与计算】
【资料2】铁的常见氧化物中铁的质量分数
(5)称取铁红样品10.0g用上述装置进行实验,测定铁红中铁的质量分数.
①D中充分反应后得到Fe粉的质量为mg,则m的取值范围是7.0<m<7.78.
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是76.0%.(计算结果精确到0.1%)
【实验评价】
(6)本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会偏小(填“偏小”、“不变”或“偏大”).
【资料1】草酸晶体(H2C2O4•3H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O4•3H2O$\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$CO2↑+CO↑+4H2O
【问题讨论】用如图所示装置进行实验:

(1)实验前应先检查装置的气密性.
(2)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是c、a(填字母编号)
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)B装置的作用是检验二氧化碳是否被A装置完全吸收.
(4)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前将装置中的空气排出,防止发生爆炸
②停止加热后把反应生成的二氧化碳全部排入E装置中.
【数据分析与计算】
【资料2】铁的常见氧化物中铁的质量分数
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 铁的质量分数 | 77.8% | 70.0% | 72.4% |
①D中充分反应后得到Fe粉的质量为mg,则m的取值范围是7.0<m<7.78.
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是76.0%.(计算结果精确到0.1%)
【实验评价】
(6)本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会偏小(填“偏小”、“不变”或“偏大”).
16.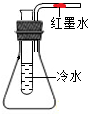 如图所示,导管内有一段红墨水,试管中盛有适量的冷水,容器的气密性良好.现往试管中加入下列某种物质,红墨水不会移动的是( )
如图所示,导管内有一段红墨水,试管中盛有适量的冷水,容器的气密性良好.现往试管中加入下列某种物质,红墨水不会移动的是( )
 如图所示,导管内有一段红墨水,试管中盛有适量的冷水,容器的气密性良好.现往试管中加入下列某种物质,红墨水不会移动的是( )
如图所示,导管内有一段红墨水,试管中盛有适量的冷水,容器的气密性良好.现往试管中加入下列某种物质,红墨水不会移动的是( )| A. | 氢氧化钠固体 | B. | 生石灰 | C. | 浓硫酸 | D. | 蔗糖 |
 如图是某同学正在绘制的在实验室用混合物制取氧气的装置图
如图是某同学正在绘制的在实验室用混合物制取氧气的装置图

