题目内容
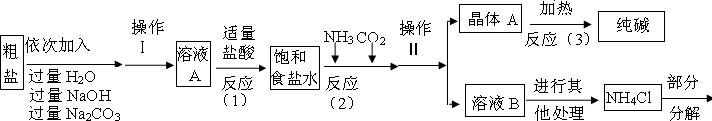
氯化钡是一种可溶性重金属盐,广泛应用于化工领域,用毒重石(主要成分为BaCO3)制备氯化钡晶体工艺流程如下:

(1)毒重石要进行粉碎的目的是 ,气体X的化学式为 ;
(2)操作Y的名称是 ,滤液2中可循环利用的物质除水外还有 ;
洗涤氯化钡晶体最适宜的洗涤剂是 (填字母);
A.30℃水 B.30℃饱和氯化钠溶液 C.30℃饱和氯化钡溶液
(3)滤渣水洗的目的是 。
【解析】(1)运用毒重石要进行粉碎能增大和盐酸的接触面积加快反应速率
(2)运用碳酸钡和稀盐酸反应生成氯化钡和水还有二氧化碳,故滤液2是氯化钡的水溶液、洗涤氯化钡晶体不能再使其溶解解答
(3)运用氯化钡属重金属盐对生产和生活不利,水洗滤渣即可提高生产率又可减少污染解答.
【答案】
(1) 加快反应速率 , CO2 ;
(2) 过滤 , 氯化钡 , C ;
(3)提高原料的利用率,减少可溶性重金属钡盐对环境的污染(答对一点即给分)

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
亚硫酸钠(Na2SO3)在生活中可作防腐剂,在印染工业作为脱氧剂和漂白剂,现在实验存放较久的白色亚硫酸钠,学校的化学兴趣小组对它的成份进行探究.
查阅资料:
1亚硫酸钠在空气中易氧化成硫酸钠,不与二氧化碳反应
2亚硫酸钠溶液呈碱性,硫酸钠溶液呈中性
3亚硫酸钠与盐酸反应能生成盐、水和二氧化硫,与硝酸反应会氧化成硫酸钠
4亚硫酸钠与可溶性的钙、钡盐反应会产生白色沉淀
小芳阅读了上述的资料后,对这瓶白色固体进行了猜想与探究
猜想:
a白色粉末只有Na2SO3
b白色粉末只有______
c白色粉末是Na2SO3与Na2SO4的混合物
为了验证b的猜想,小芳选取了无色酚酞溶液、氯化钡溶液、稀硝酸中的一种进行以下探究,请帮她完成.
为进一步验证该白色粉末的组成,小麦做了以下的实验:
查阅资料:
1亚硫酸钠在空气中易氧化成硫酸钠,不与二氧化碳反应
2亚硫酸钠溶液呈碱性,硫酸钠溶液呈中性
3亚硫酸钠与盐酸反应能生成盐、水和二氧化硫,与硝酸反应会氧化成硫酸钠
4亚硫酸钠与可溶性的钙、钡盐反应会产生白色沉淀
小芳阅读了上述的资料后,对这瓶白色固体进行了猜想与探究
猜想:
a白色粉末只有Na2SO3
b白色粉末只有______
c白色粉末是Na2SO3与Na2SO4的混合物
为了验证b的猜想,小芳选取了无色酚酞溶液、氯化钡溶液、稀硝酸中的一种进行以下探究,请帮她完成.
| 实验操作 | 现象 | 结论 |
| 取样品置于烧杯中,加入 ______; | ______; | 猜想b不成立 |
| 实验操作 | 现象 | 结论 |
| 取14.6g的白色固体,加入 ______; | 有气体产生 | 证明白色固体肯定含有______; 可能含有______. |
| 把上述气体通入氢氧化钠溶液中,测得其增重6.4g | 确认白色固体是______. |
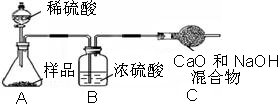 小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为
小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为
 小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为______(必须要有写出计算过程,请在下方写出)
小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为______(必须要有写出计算过程,请在下方写出)