题目内容
1.某化学兴趣小组的同学做粗盐(含有不溶性杂质)提纯实验,并用所得精盐配制50g 5%的氯化钠溶液.实验一:如图是同学们做粗盐提纯实验的操作示意图.请回答下列问题:

(1)操作⑥中的错误没用玻璃棒引流,若几次过滤后滤液仍浑浊,原因可能是滤纸破损,液面没低于滤纸边缘,盛滤液的烧杯不干净.
(2)粗盐提纯实验的操作顺序为(填操作序号)①⑤②③⑥④、称量精盐并计算产率;
(3)在操作④中,当观察到蒸发皿中出现较多量固体 时,停止加热.
实验二:用提纯得到的精盐配制50g5%的氯化钠溶液.经检测溶质质量分数偏小,其原因可能有(填下列序号)①②③.
①氯化钠固体仍然不纯 ②称量时砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出.
分析 (1)过滤时应该用玻璃棒引流;
如果滤纸破损,液面没低于滤纸边缘,盛滤液的烧杯不干净,都能够导致过滤后滤液仍浑浊;
(2)粗盐提纯实验的操作顺序为:取出药品,称量,把粗盐和水转移到烧杯中溶解,过滤,蒸发即可;
(3)蒸发溶液时,不能把水全部蒸发后才停止加热,应该在蒸发皿中出现较多量固体时,停止加热;
如果操作不当,会影响实验结果,甚至会导致实验失败.
解答 解:实验一:
(1)操作⑥中的错误是没用玻璃棒引流;
如果滤纸破损,液面没低于滤纸边缘,盛滤液的烧杯不干净,都能够导致滤液浑浊.
故填:没用玻璃棒引流;滤纸破损,液面没低于滤纸边缘,盛滤液的烧杯不干净.
(2)粗盐提纯实验的操作顺序为:取出药品,称量,把粗盐和水转移到烧杯中,加入水搅拌溶解,再过滤,蒸发即可得到精盐.
故填:①⑤②③⑥④.
(3)在操作④中,当观察到蒸发皿中出现较多量固体时,停止加热.
故填:蒸发皿中出现较多量固体.
实验二:
①氯化钠固体仍然不纯时,会导致氯化钠质量偏小,从而导致配制的氯化钠溶液中溶质质量分数偏小;
②称量时砝码端忘垫质量相同的纸片,会导致氯化钠质量偏小,从而导致配制的氯化钠溶液中溶质质量分数偏小;
③量取水时仰视读数会导致量取的水的质量偏大,从而导致配制的氯化钠溶液中溶质质量分数偏小;
④装瓶时,有少量溶液洒出,不影响溶质质量分数.
故填:①②③.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
11.逻辑推理是化学学习中常用的思维方法.以下推理正确的是( )
| A. | 单质中只含一种元素,只含一种元素的物质就是单质 | |
| B. | 化合物都是由不同种元素组成的,所以不同种元素组成的纯净物一定是化合物 | |
| C. | 活泼金属与稀盐酸反应放出气体,能与稀盐酸反应放出气体的物质一定是金属 | |
| D. | 燃烧伴有发光、放热现象,所以有发光、放热现象就一定是燃烧 |
12. 溶液在生产和生活中有重要意义.如图是A、B、C三种固体物质的溶解度曲线,则下列判断正确的是( )
溶液在生产和生活中有重要意义.如图是A、B、C三种固体物质的溶解度曲线,则下列判断正确的是( )
 溶液在生产和生活中有重要意义.如图是A、B、C三种固体物质的溶解度曲线,则下列判断正确的是( )
溶液在生产和生活中有重要意义.如图是A、B、C三种固体物质的溶解度曲线,则下列判断正确的是( )| A. | t1℃时,A、B、C三种物质的溶液浓度从大到小的关系是B>A=C | |
| B. | A的不饱和溶液可通过升温、蒸发、添加溶质的方式变为饱和 | |
| C. | t2℃时,等质量的饱和A、B、C溶液降温至t1℃,A析出晶体最多 | |
| D. | A的浓溶液中含有少量C的时候,可用加热蒸发结晶的方式提纯A |
9.如图是甲、乙两种固体物质的溶解度曲线,下列说法不正确的是( )


| A. | t1℃时,甲、乙两种物质的溶解度相等 | |
| B. | 若固体甲中含有少量乙时可用蒸发结晶方法提纯甲 | |
| C. | t2℃用等质量的甲、乙两种物质配制甲、乙的饱和溶液需要水的质量甲小于乙 | |
| D. | 已知t2℃甲的溶解度为50g,在t2℃时将50g甲物质加入到50g水中,充分溶解得到75g溶液 |
6.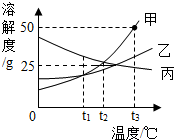 如图是甲、乙、丙三种固体物质的溶解度曲线,请你结合所给曲线,判断下列说法正确的是( )
如图是甲、乙、丙三种固体物质的溶解度曲线,请你结合所给曲线,判断下列说法正确的是( )
 如图是甲、乙、丙三种固体物质的溶解度曲线,请你结合所给曲线,判断下列说法正确的是( )
如图是甲、乙、丙三种固体物质的溶解度曲线,请你结合所给曲线,判断下列说法正确的是( )| A. | 在t3℃时,甲的溶解度是50 | |
| B. | t2℃时,甲、丙二种物质的饱和溶液溶质质量分数为20% | |
| C. | t1℃时,甲、乙、丙三种物质的饱和溶液中,溶质质量分数的大小关系是丙>甲>乙 | |
| D. | 温度降低到t2℃时,甲、乙的溶解度相等,得到甲的饱和溶液 |
10.水电解产生氢气和氧气,则化学计量数之比:ν(H2):ν(O2)等于( )
| A. | 1:1 | B. | 2:1 | C. | 2:32 | D. | 4:32 |
11.将硫酸渣中金属元素进行分离的一种工艺流程如图所示

【查阅资料】
Ⅰ.相关数据
Ⅱ.25℃时,Al(OH)3可溶于pH>6.0的碱溶液,并转化为AlO2-
【流程分析】
(1)在实验室完成操作①需要的玻璃仪器有烧杯、玻璃棒和漏斗
(2)所加稀盐酸必须过量的原因是使硫酸渣完全溶解
(3)向溶液A中加入试剂M调节pH到7的过程中,沉淀的颜色会经历“红褐色变淡,再变深”的过程,出现该现象的原因是氢氧化钠会与氯化铁反应生成氢氧化铁沉淀,氢氧化铁沉淀会溶于酸,盐酸消耗完后,氢氧化铁沉淀的沉淀量会逐渐增多,颜色变深
(4)溶液B中加入试剂M调节pH=13时,发生反应的化学方程式是AlCl3+4NaOH=NaAlO2+2H2O+3NaCl,MgCl2+2NaOH=Mg(OH)2↓+2NaCl
(5)高温灼烧固体X时,X能在保持各元素化合价不变的前提下分解为两种氧化物,该反应的化学方程式是2Fe(OH)3$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2O
(6)如果操作②是蒸发结晶,则不可能得到纯净的NaAlO2固体,理由是:溶液C中含有反应生成的氯化钠.

【查阅资料】
Ⅰ.相关数据
| 25℃时,氢氧化钠沉淀的pH范围 | |||
| Fe(OH)3 | Al(OH)3 | Mg(OH)2 | |
| 开始沉淀的pH | 1.5 | 3.3 | 10.4 |
| 沉淀完全的pH | 3.2 | 5.2 | 12.4 |
【流程分析】
(1)在实验室完成操作①需要的玻璃仪器有烧杯、玻璃棒和漏斗
(2)所加稀盐酸必须过量的原因是使硫酸渣完全溶解
(3)向溶液A中加入试剂M调节pH到7的过程中,沉淀的颜色会经历“红褐色变淡,再变深”的过程,出现该现象的原因是氢氧化钠会与氯化铁反应生成氢氧化铁沉淀,氢氧化铁沉淀会溶于酸,盐酸消耗完后,氢氧化铁沉淀的沉淀量会逐渐增多,颜色变深
(4)溶液B中加入试剂M调节pH=13时,发生反应的化学方程式是AlCl3+4NaOH=NaAlO2+2H2O+3NaCl,MgCl2+2NaOH=Mg(OH)2↓+2NaCl
(5)高温灼烧固体X时,X能在保持各元素化合价不变的前提下分解为两种氧化物,该反应的化学方程式是2Fe(OH)3$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2O
(6)如果操作②是蒸发结晶,则不可能得到纯净的NaAlO2固体,理由是:溶液C中含有反应生成的氯化钠.
 2014年9月19日韩国仁川亚运会的圣火是在水的包围下被点燃的,在火炬的底部还不
2014年9月19日韩国仁川亚运会的圣火是在水的包围下被点燃的,在火炬的底部还不