��Ŀ����
����Ŀ����۱�ʶ����̽���ǻ�ѧѧϰ�Ķ���˼ά��
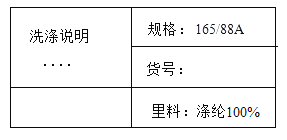
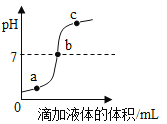
(1)��ͼ����������������Һ(�ѵμ�������̪��Һ)�������μ�ϡ�����̽��ʵ�顣��ش�:

�ٴӺ�۽Ƕȿ��Կ�����ϡ����μӵ�10mLʱ����Һ����ɫ�仯Ϊ______________����ʱ��Һ���¶���________________��
�ڵ���Һ���¶Ƚ�Ϊ38��Cʱ����֤����Һ�����������Ƶ�ʵ�鷽����________________(�����)��
AƷ���ձ�����Һ��ζ��
B����մȡ�ձ��е���Һ�������Ƿ�����ā��
C���ձ����ٵμ���������������Һ���۲�˲����Һ��ɫ
D�μ�̼������Һ���۲�����������
����ͼA��ʾ����NaHSO4��Һ�еμ�NaOH��Һ���ɷ�Ӧ��ʵ�ʿ����ƶϣ�����NaHSO4ˮ��Һ�м������Zn���ܷ��������______ (�� ����������������)��

(2)�Ȼ�������Ҫ�ĵ�ζƷ������������ȱ�ٵ�ζ������ͼ�ֱ��ʾ��ͬ�Ļ�ѧ��Ӧ�������漰���Ȼ��ơ�

�ٽ�������������ȼ�ղ����������̣�ͼ1�Ƕ��߷�Ӧ�����Ȼ��Ƶ���ʾ��ͼ����ͼ1��֪��Ԫ�صĻ�ѧ������Ҫ��ԭ�ӵ�______________(����ĸ���)�����еĹ�ϵ��
A����������
B�˵����
C���Ӳ���
D���ԭ������
��ͼ2�������Ȼ�������������Һ�ķ�Ӧ������A��B��C�������������ű�ʾ�÷�Ӧ��ʵ��____________��
��ͼ3��ʾ�������������������������________ (д��ѧʽ)���÷�Ӧ�Ļ�ѧ����ʽΪ____________��
���𰸡��ɺ�ɫ��Ϊ��ɫ 40��C CD �� A ![]() C1O2
C1O2 ![]()
��������
��1������ͼ���Կ���������������ϡ����ķ�Ӧ���ڷ��ȷ�Ӧ��ϡ����μӵ�10mLʱ��ǡ����ȫ��Ӧ����ʱ�¶���ߣ�����������ϡ������ȫ��Ӧ�����Ȼ��ƺ�ˮ���Ȼ��Ƴ����ԣ�����ʹ��ɫ��̪��ɫ������Һ����ɫ�仯Ϊ�ɺ�ɫ��Ϊ��ɫ����ʱ��Һ���¶���40����
��A����ʵ�����У�����Ʒ���κ�ҩƷ��ζ�������������⣻
B����ʵ�����У��������ֽӴ�ҩƷ�����������⣻
C�����ձ����ٵμ���������������Һ���۲�˲����Һ��ɫ�������Һ��ɫ�ȱ����Ϊ��ɫ��˵����Һ�к������ᣬ�����������ƣ��������⣻
D���μ�̼������Һ��̼��������ϡ���ᷴӦ���ɶ�����̼���壬�������ݲ�����˵����Һ�к������ᣬ�����������ƣ��������⡣��ѡCD��
����ͼ��֪��NaHSO4��Һ�к��������ӣ�����NaHSO4ˮ��Һ�м������Zn��Zn���������ӷ�Ӧ�������������ܲ������壻
��2������ͼ��֪����������ѧ��Ӧʱ��ԭ�ӵ����������������˸ı䣬��֪Ԫ�صĻ�ѧ������ԭ�ӵ�������������ء���ѡA��
����ͼ��֪���÷�Ӧ��ʵ���������Ӻ������ӽ���γ����Ȼ����������ʸ÷�Ӧ��ʵ���ǣ�![]() ��
��
����ͼ��֪��ͼ3��ʾ������������������������ǣ�ClO2����Ϊ����������Ԫ����ɣ�����һ��Ԫ��Ϊ��Ԫ�صĻ�����÷�Ӧ�Ļ�ѧ����ʽΪ��![]() ��
��

����Ŀ�������仯����������������Ӧ�÷dz��㷺��
��һ�������ϵ��й�֪ʶ

��1������ʹ�ý����Ⱥ���������ͭ������������ʱ����ֱ�������ſ�ʼ����ʹ�������ϡ���Ҳ��ӳ��Cu��Fe�� Al���ֽ����Ļ����ǿ������˳����_______________��
��2��������������˾�ϣ���ͼ���IJ��ϣ�������������������������Ҫ��________________��
��3���ҹ�C919���Ϳͻ�ȥ�꾪�����࣬�ͻ��ϴ��ģʹ��̼��ά���ϲ��ϡ���﮺Ͻ����ѺϽ������մɵ��Ƚ����ϣ����в��漰���IJ�����_________��ѡ����ţ���
A �Ͻ�
B ���ǽ�������
C �ϳɲ���
D ���ϲ���
��4������ʯ�г�������������FeS2���ȡ���ҵ���û�������ȡ���������������������������ԭ����:��ұ���в���SO2��Ⱦ��������______________��
��������ȡ��ʽ������
��ʽ��������-�ַ�ˮ�������������᳧�ķ�������Ҫ�ɷ�Ϊ�������������FeS��SiO2���Ʊ���ʽ����������[Fe4��OH��2��SO4��5��6H2O]��Ҫ��������:

��1������Ӧ��ĥ�ɷ�ĩ��Ŀ����_____��
��2��������������������H2S����Ļ�ѧ����ʽΪ________
��3�����˺�ϴ�ӣ�֤��������ϴ���ķ�����_______��
��4����ת����������Ӧ�Ļ�ѧ����ʽΪ_______���÷�Ӧ�¶Ȳ��˹��ߵ�ԭ����________��
��������ʽ������������ȷֽ�ʵ��
��ȤС���ȡ�˾�����Ʒ25.38g���ڿ�����Ա��ָ��������ͼװ�ý����ȷֽ�ʵ�顣
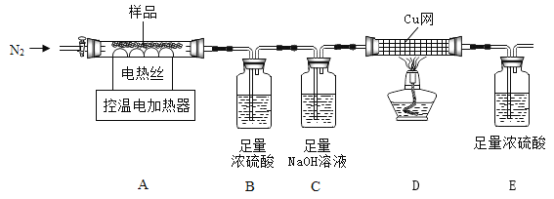
[��������]�ټ�ʽ���������壨��Է�������Ϊ846��200��C��ȫ�ֽ�����Fe2O3��H2O��Fe2��SO4��3��
��Fe2��SO4��3��500��C��ȫ�ֽ�ΪFe2O3��SO2��SO3��O2��
��Bװ����Ũ����ֻ������SO3��H2O��.
��1��װ���ʵ��װ�ú���Ҫ_________��
��2������ǰ�����о�ͨ��N2,ֹͣ���Ⱥ����ͨN2��Ŀ���Ƿ�ֹ������______��
��3�����Ʋ�ͬ���¶ȶ�A�й�����ȣ����װ��B��C��D�е������仯���±������ʣ������������¶ȵı仯��ͼ��ʾ��

�¶�/C | ���� | 220 | 520 |
Bװ��/g | 200.00 | 203.78 | 207.78 |
Cװ��/g | 200.00 | 200.00 | x |
Dװ��/g | 100.00 | 100.00 | 101.60 |
����ͼ��m1=____________��
�ڱ�����x=_____________��
�۽����յ�ʣ�����������ȵ����ߵ��¶ȣ����ֹ������0.32g���������ٸı䣬д���˹����з�����Ӧ�Ļ�ѧ����ʽ____________��