题目内容
9.为测定某钢样(该钢样是铁.碳的合金)中碳的质量分数,取钢样粉碎后,加入146.6g稀硫酸,恰好完全反应,产生气体0.2g,剩余固体0.1g.计算:(1)钢样中碳的质量分数(计算结果精确到0.1%)
(2)实验后所得溶液中溶质的质量分数.
分析 铁和稀硫酸反应生成硫酸亚铁和氢气,根据反应的化学方程式及其提供的数据可以进行相关方面的计算.
解答 解:(1)设铁的质量为x,反应生成硫酸亚铁质量为y,
Fe+H2SO4═FeSO4+H2↑,
56 152 2
x y 0.2g
$\frac{56}{x}$=$\frac{152}{y}$=$\frac{2}{0.2g}$,
x=5.6g,y=15.2g,
钢样中碳的质量分数为:$\frac{0.1g}{0.1g+5.6g}$×100%=1.8%,
钢样中碳的质量分数是1.8%.
(2)实验后所得溶液中溶质的质量分数为:$\frac{15.2g}{146.6g+5.6g-0.2g}$×100%=10%,
答:实验后所得溶液中溶质的质量分数为10%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
20.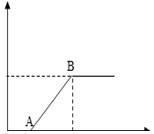 下表中的选项符合图所示的曲线的是( )
下表中的选项符合图所示的曲线的是( )
 下表中的选项符合图所示的曲线的是( )
下表中的选项符合图所示的曲线的是( )| 选项 | 横坐标 | 纵坐标 |
| A | 某温度下,向接近饱和的氯化钠溶液中加入氯化钠晶体 | 溶液中溶质的质量分数 |
| B | 向碳酸钠和碳酸钾混合溶液中加入稀盐酸的质量 | 产生气体的质量 |
| C | 向一定量的澄清石灰水和氢氧化钡混合溶液中加入碳酸钠溶液的质量 | 生成沉淀的质量 |
| D | 向氯化铁和盐酸的混合溶液中加入过量氢氧化钠溶液 | 生成沉淀的质量 |
| A. | A | B. | B | C. | C | D. | D |
17.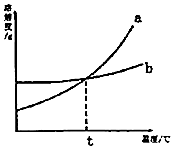 如图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )
如图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )
 如图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )
如图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )| A. | a物质的溶解度受温度的影响比b物质小 | |
| B. | t℃时,a、b饱和溶液中含有相同质量的溶质 | |
| C. | t℃时,a的饱和溶液升温,溶质的质量分数变大 | |
| D. | a中含有少量b时,用冷却热饱和溶液的方法提纯a |
14.如图为元素周期表中的一格,对图中信息解释正确的是( )
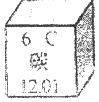

| A. | 核外电子数为12 | B. | 碳原子核内质子数为12 | ||
| C. | 核外电子数为6 | D. | 碳的相对原子质量为12.01g |
19.在一个密闭的容器中有甲、乙、丙、丁四种物质,在一定条件充分反应,测得反应前后各物质的质量如表,下列正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 3 | 8 | 5 | 4 |
| 反应后质量/g | X | 2 | 5 | 6 |
| A. | 待测值X=4 | |
| B. | 该反应为化合反应 | |
| C. | 丙一定是该反应的催化剂 | |
| D. | 反应过程中甲和丁变化的质量比为2:1 |