题目内容
高温下赤热的焦炭能与水蒸气发生反应生成无色的气体,探究小组同学对其反应后生成的气体作了如下探究:
【猜想与假设】假设①:生成的气体可能有H2、CO;
假设②:生成的气体可能有H2、CO2、 ;
假设③:生成的气体可能有H2、CO、CO2、N2;
假设④:……
探究小组组长认为③的猜想不合理,他作出判断的理论依据是
。
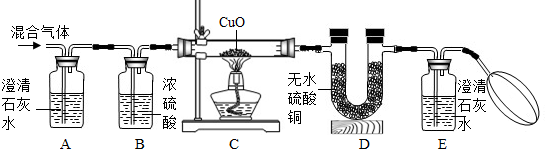
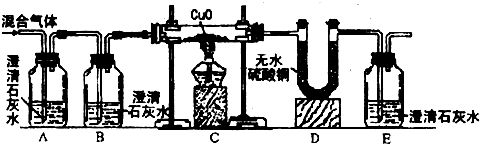
【设计与实验】为了证明他们的猜想是正确的,设计了如下图所示的实验装置:
提示: 浓硫酸作干燥剂,无水硫酸铜遇到水变蓝色,H2和CuO反应生成Cu和H2O,CO与CuO反应的原理与工业炼铁的反应原理相似。)

① 证明混合气体中含有H2,相应的反应现象是
;
② 证明混合气体中含有CO,相应的反应现象是
;
③ 证明混合气体中含有CO2,相应的反应现象是
。
【结论与思考】实验后得出结论,假设①成立。
① 写出焦炭与水蒸气发生反应的化学方程式 ;
② 有同学认为尾气直接排出会污染空气,应如何处理更合理:
。
【猜想与假设】CO 反应物中没有N元素,根据质量守恒定律不可能生成N2
【设计与实验】①D中无水硫酸铜变蓝色 ②E中澄清石灰水变浑浊 ③A中澄清石灰水变浑浊
【结论与思考】 ①C+H2O高温 H2+CO ②在尾气排出处加一盏点燃的酒精灯或用空的气囊收集(合理给分)
【解析】
试题分析:由题意可得:
【猜想与假设】
假设②:生成的气体可能有H2、CO2、CO;
探究小组组长认为③的猜想不合理,他作出判断的理论依据是反应物中没有N元素,根据质量守恒定律不可能生成N2。
【设计与实验】① 证明混合气体中含有H2,相应的反应现象是D中无水硫酸铜变蓝色;
② 证明混合气体中含有CO,相应的反应现象是E中澄清石灰水变浑浊;
③ 证明混合气体中含有CO2,相应的反应现象是A中澄清石灰水变浑浊。
【结论与思考】
① 焦炭与水蒸气发生反应的化学方程式为C+H2O高温 H2+CO;
② 有同学认为尾气直接排出会污染空气,应在尾气排出处加一盏点燃的酒精灯或用空的气囊收集(合理给分)。
考点:实验设计与探究;质量守恒定律;氢气、一氧化碳、二氧化碳的性质与检验;化学方程式的书写;空气污染与保护。
点评:本题考查的内容较多,难度较大,解题的关键是了解氢气、一氧化碳、二氧化碳的性质。题中无水硫酸铜是用来检验水的,有水则变蓝色;二氧化碳能使澄清石灰水变浑浊,这是检验二氧化碳的特征反应。化学反应遵守质量守恒定律,反应前后,原子的种类、个数、质量都不变。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案