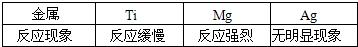
题目内容
镁、铁、锌分别与稀盐酸反应,生成等质量H2时,则参加反应的镁铁锌的原子个数之比是( )
| A.1:2:3 | B.3:2:1 | C.1:1:1 | D.6:3:2 |
假定氢气的物质的量是Nmol,金属的物质的量为A,设生成Nmol氢气需要金属的物质的量是X.
A+2HCl═ACl2+H2↑
1mol 1mol
X Nmol
═
得:X=Nmol
∴生成氢气Nmol,需要三种金属的物质的量都是Nmol,因为三种金属的原子个数比等于物质的量之比,所以三种金属原子个数比=Nmol:Nmol:Nmol=1:1:1.
故选C.
A+2HCl═ACl2+H2↑
1mol 1mol
X Nmol
| 1mol |
| 1mol |
| X |
| Nmol |
得:X=Nmol
∴生成氢气Nmol,需要三种金属的物质的量都是Nmol,因为三种金属的原子个数比等于物质的量之比,所以三种金属原子个数比=Nmol:Nmol:Nmol=1:1:1.
故选C.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目