题目内容
将8.8g氧化铜在加热条件下,用CO还原一段时间后,质量减少0.8g,试回答:
(1)有多少克氧化铜被还原。
(2)剩余固体中含有哪些物质?各多少克?
(1)有多少克氧化铜被还原。
(2)剩余固体中含有哪些物质?各多少克?
解:设被还原的CuO的质量为χ。
(1)根据氧化铜的化学式可得出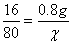 ,χ=49g
,χ=49g
(2)被还原出Cu的质量为:49×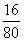 =3.2g(此步也可根据被还原的CuO的质量和化学方程式计算)
=3.2g(此步也可根据被还原的CuO的质量和化学方程式计算)
剩余CuO的质量=8.8g-4g= 4.8g
答:有49氧化铜被还原;剩余固体中有CuO和Cu,质量分别为4.8g和3.2g
(1)根据氧化铜的化学式可得出
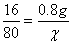 ,χ=49g
,χ=49g(2)被还原出Cu的质量为:49×
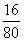 =3.2g(此步也可根据被还原的CuO的质量和化学方程式计算)
=3.2g(此步也可根据被还原的CuO的质量和化学方程式计算)剩余CuO的质量=8.8g-4g= 4.8g
答:有49氧化铜被还原;剩余固体中有CuO和Cu,质量分别为4.8g和3.2g

练习册系列答案
相关题目
解决问题常面临着方法的选择,面对不同的结果我们应继续探索.为得知15.8 g高锰酸钾完全分解能产生多少克氧气,小柯与小妍分别采取了以下方法:
请回答:
(1)在本实验条件下,氧气的密度为1.4×l0-3g/mL,则由小柯的测量结果可算出15.8 g高锰酸钾分解后所产生的氧气质量为 g(结果保留一位小数).
(2)大家经过讨论,认为小妍的计算方法明显错误,本题不能采用该方法计算氧气质量的一项理由是 .
A.高锰酸钾中含氧元素B.锰酸钾和二氧化锰中含氧元素C.氧气中含氧元素
(3)请计算15.8 g高锰酸钾完全分解所产生的氧气质量.(写出解题过程)
(4)若实验操作无误,不考虑实验中的误差,针对小柯的测定结果与你的计算结果,请提出一种合理的猜测: .
| 小柯:实验测定法 | 小妍:计算法 | ||||
| 小柯在老师的指导下,将15.8g高锰酸钾充分加热,得到氧气1300mL. | 解:高锰酸钾中氧元素的质量分数=
=
=40.5% 氧气的质量为15.8g×40.5%=6.4g 答:15.8g高锰酸钾完全分解产生氧气6.4g. |
(1)在本实验条件下,氧气的密度为1.4×l0-3g/mL,则由小柯的测量结果可算出15.8 g高锰酸钾分解后所产生的氧气质量为
(2)大家经过讨论,认为小妍的计算方法明显错误,本题不能采用该方法计算氧气质量的一项理由是
A.高锰酸钾中含氧元素B.锰酸钾和二氧化锰中含氧元素C.氧气中含氧元素
(3)请计算15.8 g高锰酸钾完全分解所产生的氧气质量.(写出解题过程)
(4)若实验操作无误,不考虑实验中的误差,针对小柯的测定结果与你的计算结果,请提出一种合理的猜测:

 (2008?遵义)碱式碳酸铜[化学式Cu2(OH)2CO3,相对分子质量为222]加热完全分解后生成的黑色固体是什么?甲、乙、丙、丁四位同学对此进行探究.请你与他们一起,踏上探究之路.
(2008?遵义)碱式碳酸铜[化学式Cu2(OH)2CO3,相对分子质量为222]加热完全分解后生成的黑色固体是什么?甲、乙、丙、丁四位同学对此进行探究.请你与他们一起,踏上探究之路. 研究性学习小组对炭粉与氧化铜反应产物中的气体成分进行研究:
研究性学习小组对炭粉与氧化铜反应产物中的气体成分进行研究: