题目内容
17.某同学对含有泥沙的粗盐进行提纯,并用提纯后的氯化钠来配制50g质量分数为5%的氯化钠溶液,请填空并回答有关问题:(1)按下面步骤提纯粗盐:
①取一定质量的粗盐样品,加水溶解;
②通过过滤操作将泥沙除去;
③将滤液移入蒸发皿,蒸发结晶,得到氯化钠晶体.
(2)在上述实验(1)的三个步骤中,都使用了同一仪器(填名称);它在步骤①和③的操作方法相同,但目的不同,步骤 ①的目的是加速溶解;步骤③的目的是防止局部温度过高而造成液滴飞溅.
(3)利用上述实验得到的氯化钠晶体,配制50g质量分数为5%的氯化钠溶液:
①溶液配制的步骤:计算、称量、溶解、装瓶;
②量取所需的水应选用50mL的量筒.
分析 (1)根据粗盐的主要成分是氯化钠,根据氯化钠易溶于水、泥沙等杂质难溶于水进行分析解答;
(2)根据溶解、过滤、蒸发操作所需的仪器进行分析解答;
(3)①根据配制溶质质量分数一定的溶液的基本步骤进行分析解答;
②利用溶质质量=溶液质量×溶质的质量分数,溶剂质量=溶液质量-溶质质量,根据溶液的质量和溶质的质量分数,计算配制溶液所需要的水的质量;进而由所需水的体积判断所需量筒的量程.
解答 解:(1)粗盐的主要成分是氯化钠,氯化钠易溶于水、泥沙等杂质难溶于水,取一定质量的粗盐样品,加水溶解,使不溶物与食盐初步分离→过滤(把泥沙除去)→将滤液移入蒸发皿,蒸发结晶,得到氯化钠晶体蒸发;
(2)溶解、过滤、蒸发操作中都要用到的实验仪器是玻璃棒,它在步骤①溶解和③蒸发的操作方法相同,但目的不同,①溶解中作用是搅拌,加快食盐的溶解速率,③蒸发的作用是搅拌,防止滤液飞溅;
(3)①配制50g质量分数为5%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解、装瓶;
②溶质质量=溶液质量×溶质的质量分数,配制50g质量分数为5%的氯化钠溶液,需氯化钠的质量=50g×5%=2.5g;溶剂质量=溶液质量-溶质质量,则所需水的质量=50g-2.5g=47.5g(合47.5mL),应选用50mL的量筒.
故答案为:(1)②过滤;
(2)③玻璃棒,加速溶解,防止局部温度过高而造成液滴飞溅;
(3)②50.
点评 本题难度不大,掌握粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、所需的仪器、配制溶质质量分数一定的溶液的基本步骤等是正确解答本题的关键.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
5.化学实验中处处表现出变化美,下列化学实验中的现象不符合实验事实的是( )
| A. | 二氧化碳气体能使干燥的石蕊试液变红 | |
| B. | 铁在氧气中剧烈燃烧,火星四射,生成黑色固体 | |
| C. | 高温加热木炭与氧化铜的混合物,固体由黑色变成红色 | |
| D. | 硫在氧气中燃烧,火焰呈蓝紫色,生成有刺激性气味的气体 |
12.下列有关水的变化中,属于化学变化的是( )
| A. | 水流动 | B. | 水结冰 | C. | 煮沸水 | D. | 电解水 |
2.实验室需收集一瓶约混有$\frac{1}{4}$体积空气的氧气,下列操作正确的是( )
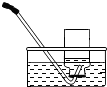 | 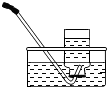 | 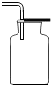 | 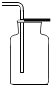 |
| 集气瓶中灌$\frac{1}{4}$的水 | 集气瓶中灌$\frac{3}{4}$的水 | 导管伸入到集气瓶体积的$\frac{1}{4}$处 | 导管伸入到集气瓶体积的$\frac{3}{4}$处 |
| A. | A | B. | B | C. | C | D. | D |
9.有关物质用途正确的是( )
| A. | 氢氧化钠降低土壤酸性 | B. | 用BaCl2处理大量泄漏的浓硫酸 | ||
| C. | 氢氧化钙用于治疗胃酸过多 | D. | 熟石灰配制农药波尔多液 |
14.下列物质中最易与血红蛋白结合的是( )
| A. | 氧气 | B. | 二氧化碳 | C. | 一氧化碳 | D. | 氮气 |
 某化肥经销商发布如下一则广告,请你分析这则广告是否科学.
某化肥经销商发布如下一则广告,请你分析这则广告是否科学. 随着日本福岛核电站放射性碘泄漏,碘这种元素被人们所关注.如图
随着日本福岛核电站放射性碘泄漏,碘这种元素被人们所关注.如图