题目内容
16.在一定条件下,下列物质在密闭容器内充分反应后,测得反应前后各物质的质量如下:下列说法正确的是( )| 物质 | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
| 反应前质量/g | 2.3 | 4 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 2.2 | 2.7 | 待测 |
| A. | 反应后X的质量为1.5g | B. | X中两种元素的质量比为1:13 | ||
| C. | X中一定含有碳元素和氢元素 | D. | X中一定含有碳元素和氧元素 |
分析 依据化学反应中反应物的质量会减小生成物的质量会增加,且反应物的质量之和应该等于生成物的质量总和,然后依据反应前后元素的质量相等进行分析判断即可.
解答 解:在该反应中乙醇及氧气的质量减小,所以是反应物,二氧化碳和水质量增加是生成物,且参加反应的物质质量等于2.3g+4g=6.3g,而生成物二氧化碳和水的质量是2.2g+2.7g=4.9g,所以X是生成物,且质量是6.3g-4.9g=1.4g,其反应的表达式为乙醇+氧气→二氧化碳+水+X.
A、由以上分析知X等于1.4g,故说法错误;
B、2.3g乙醇中含有的碳元素质量是2.3g×$\frac{24}{46}$=1.2g,反应后二氧化碳中氧元素的质量是2.2g×$\frac{32}{44}$=1.6g,碳元素质量是2.2g-1.6g=0.6g,碳元素质量不等,所以X中一定含有碳元素,水中的氧元素是2.7g×$\frac{16}{18}$=2.4g,两者中氧元素的和与反应的氧气质量相等,因为乙醇中还含有氧元素,所以X中一定含有氧元素;由以上分析知X中含有碳氧两种元素(1.2g-0.6g):2.3g×$\frac{16}{46}$=3:4,故说法错误;
C、反应的乙醇中氢元素的质量是2.3g×$\frac{6}{46}$=0.3g,而水中的氢元素质量是2.7g×$\frac{2}{18}$=0.3g,所以X中不可能含有氢元素,故说法错误;
D、由以上分析知X中一定含有碳元素和氧元素,故说法正确.
故选D.
点评 此题是一道依据质量守恒定律的考查题,解题的关键是利用反应前后元素的质量不会变化,并结合化学式的相关计算对物质元素的含有情况进行分析,此题难度较大较好的利用了所学的基础知识,属中考题中的压轴题.

练习册系列答案
相关题目
17.属于化学反应的是( )
| A. | 将金属银打造成银牌 | B. | 使水凝固成冰 | ||
| C. | 水烧开成热水 | D. | 生石灰干燥食品 |
11.根据如图信息,下列理解错误的是( )
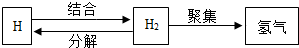

| A. | 原子可结合成分子 | |
| B. | 氢分子的形成过程可表示为: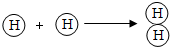 | |
| C. | 物质都是由分子构成 | |
| D. | 化学变化的实质是分子的分裂和原子的重新组合 |
1.下列对自然资源和利用过程只发生物理变化的是( )
| A. | 分离液态空气制氧气 | |
| B. | 秸秆、杂草、粪便等在沼气中发酵 | |
| C. | 从铝土矿(主要成分是Al2O3)中提炼金属铝 | |
| D. | 自来水通过投药消毒消除天然水中的有害细菌 |
 A、B、C、D、E、F六种物质中只有四种元素,且只有单质和氧化物:E、F均为黑色固体,其中F是产量最大的金属:A、B都是呼出气体中的成分,且相互反应的生成物能使紫色石蕊试液变红色.请回答:
A、B、C、D、E、F六种物质中只有四种元素,且只有单质和氧化物:E、F均为黑色固体,其中F是产量最大的金属:A、B都是呼出气体中的成分,且相互反应的生成物能使紫色石蕊试液变红色.请回答: