题目内容
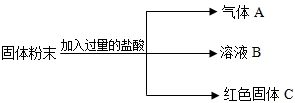
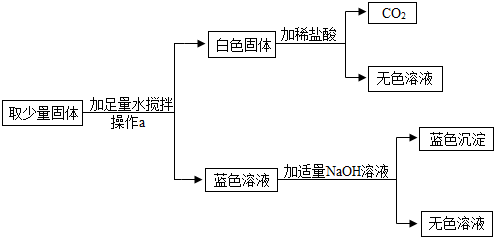
有一包固体粉末,可能是CaCO3、Na2SO4、CuSO4、Na2CO3中的一种或多种,某实验小组对其组成成分进行了以下探究活动.
思考与交流:(1)上述物质中,不溶于水的是 ① (填化学式,下同).
(2)能溶于水,其水溶液呈蓝色的是 ② .
资料查阅:Na2CO3溶液与CuSO4溶液混合能产生蓝色沉淀.
活动与探究:去一定量上述固体粉末,加足量水溶解.在溶解过程中一定要用到的玻璃仪器有 ③ 和玻璃棒,其中玻璃棒的作用是 ④ .
现象与结论:经上述操作,得到蓝色澄清溶液,则原固体粉末中一定没有 ⑤ 和 ⑥ (填化学式).
探索与拓展:为进一步确定原固体粉末的组成,该实验小组同学先用托盘天平称取46.2 g该粉末,溶于水配成174.6 g溶液,再往其中加入溶质质量分数为8%的NaOH溶液,发生如下反应:CuSO4+2NaOH=Na2SO4+Cu(OH)2↓,产生沉淀的质量与所加NaOH溶液质量的关系如图所示.据图回答:(结果保留小数点后一位)

(3)计算产生最大沉淀量时所加NaOH溶液的质量.
(4)通过计算确定46.2 g固体粉末的组成.(回答出物质名称和其质量)
(5)计算A点所示溶液中溶质的质量分数.
解析:
|
(1)①CaCO3 (2)②CuSO4 ③烧杯 ④搅拌(加速固体的溶解) ⑤CaCO3 ⑥Na2CO3 (3)解:设生成最大沉淀量时所加NaOH的质量为x,46.2 g粉末中含有CuSO4的质量为y生成Na2SO4的质量为z (4)Na2SO4的质量=46.2 g-32 g=14.2 g 1分 则46.2 g固体粉末由14.2 g Na2SO4和32.0 g CuSO4组成. (5)Na2SO4的质量分数= =12.0% 1分 |

 阅读快车系列答案
阅读快车系列答案