24. (17分)计算并填空:
(1) Al单质晶体中其晶体最小重复单元特征如下图所示,请回答:
晶体中距离Al原子最近的A1原子为__________个,一个最小单元结构中Al原子的数目为______________。
(2) 高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的制备是用硝酸铁、氢氧化钠和氯气共同反应制得的。请配平下列方程式:
□Fe (NO3)3 +□NaOH +□Cl2→□Na2FeO4 +□NaNO3 +□NaCl+□H2O
反应中氧化剂为_____________,2mol Fe (NO3)3参加反应时转移电子数为_______mol。若用石墨作电极电解0.1L的NaCl溶液,通电一段时间后,阴极收集到气体11.2L,阳极收集到气体6.72L ,则原溶液中NaCl的物质的量浓度为__________mol/L;若利用上述反应得到了等质量的NaCl,同时得到高铁酸钠的质量为_________g。
(3) ①已知:H2(g) + 1/2O2(g) = H2O(l);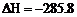 kJ/mol
kJ/mol
H2(g) = H2(l);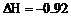 kJ/mol
kJ/mol
O2(g) = O2(l);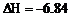 kJ/mol
kJ/mol
请写出液氢和液氧生成液态水的热化学方程式:________________________________。
②有关键能数据如表:
|
化学键 |
Si-O |
O=O |
Si-Si |
|
键能/kJ·mol-1 |
X |
498.8 |
176 |
晶体硅在氧气中燃烧的热化学方程式:Si(s)
+ O2(g) = SiO2(s),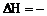 989.2
kJ·mol-1,则Si-O键的键能X的值为__________kJ·mol-1。
989.2
kJ·mol-1,则Si-O键的键能X的值为__________kJ·mol-1。
西南师大附中2008-2009学年度下期期末考试
19. (13分) 下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
⑤ |
|
|
3 |
⑥ |
|
|
⑦ |
|
|
⑧ |
|
(1) ②和⑦形成的化合物属于_____________晶体;在⑦单质所形成的晶体中,每个原子周围与_________个原子形成______________结构。
(2) ②、④、⑤的气态氢化物的沸点由高到低的顺序为________________________。
(3) ①、④、⑥、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4) ①和③形成的相对分子质量为32的一种化合物是火箭发射的燃料之一,名肼,3.2g液态肼和足量氧气燃烧生成③的单质和另一种液态化合物时放出969.0kJ的热量,请写出该反应的热化学方程式:______________________________________;若利用该反应形成燃料电池,以NaOH溶液为电解质,则负极反应式为____________________。
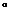 ,读图回答l-2题。
,读图回答l-2题。
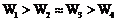
 R-CN + NaBr;②R-CN
R-CN + NaBr;②R-CN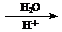 R-COOH
R-COOH
 CH3CH2OH
_______________________________________________________
CH3CH2OH
_______________________________________________________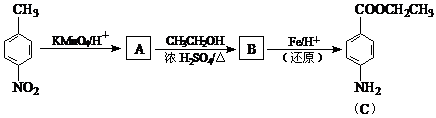
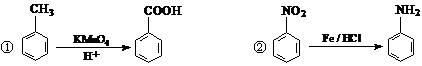
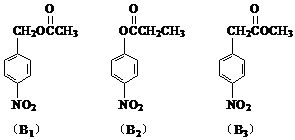
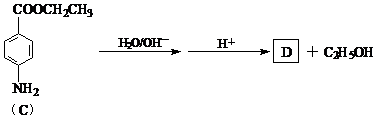


 Fe(OH)3↓+ 3H+
Fe(OH)3↓+ 3H+
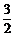 O2(g)
= CO2(g) + 2H2O(g);
O2(g)
= CO2(g) + 2H2O(g);