4.有关pH的计算
(1)酸溶液中,c(H+)酸c(H+)水≈KW;碱溶液中,c(OH-)碱c(OH-)水≈KW。
(2)强碱、强碱溶液稀释的计算
①强酸溶液,pH(稀释)=pH(原来)+lg n(n为稀释的倍数)
②强碱溶液,pH(稀释)=pH(原来)-lg n(n为稀释的倍数)
(3)强酸、强碱溶液两两等体积混合后溶液的pH计算
表5-3 强酸、强碱溶液两两等体积混合时pH的计算
|
混合物质 |
两种溶液pH关系 |
混合后溶液pH |
|
A、B均为酸 |
pHA<pHB |
pHA+0.3 |
|
A、B均为碱 |
pHA<pHB |
pHB-0.3 |
|
A是酸、B是碱 |
pHA+pHB=14 |
7 |
|
pHA+pHB<14(酸剩余) |
pHA+0.3 |
|
|
pHA+pHB>14(酸剩余) |
pHB-0.3 |
注意:酸碱溶液的pH之差必须≥2,否则误差较大。
*(4)pH、c、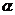 的关系
的关系
①一元弱酸溶液中,pH=-lg c(H+)=-lg(c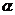 )
)
②一元弱碱溶液中,pOH=-lg
c(OH-)=-lg(c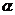 ),pH=14-POH
),pH=14-POH
注意:*部分为新教材中不作要求的部分。
水的电离和溶液的pH基础知识
3.改变溶液pH的常用方法
表5-2 改变溶液pH的方法
|
pH变化 |
采取的措施 |
|
pH增大 |
加碱 |
|
对于酸性溶液可加水稀释 |
|
|
pH减小 |
加酸 |
|
对于碱性溶液可加水稀释 |
注意:酸性溶液无限加水稀释,pH只能接近于7,且仍小于7;碱性溶液无限加水稀释时,pH只能接近于7,且仍大于7。
2.pH与溶液酸碱性的关系(25℃时)
表5-1 pH与溶液的酸碱性
|
pH |
溶液的酸碱性 |
|
pH<7 |
溶液呈酸性,pH越小,溶液的酸性越强 |
|
pH=7 |
溶液呈中性 |
|
pH>7 |
溶液呈碱性,pH越大,溶液的碱性越强 |