4.离子反应的应用
(1)物质检验与含量测定:只要对其中特定的离子进行检验或测定即可,不必对物质的所有构成离子进行检验和测定。定量测定的方法包括酸碱中和滴定法、氧化还原滴定法、沉淀滴定法、络合滴定法等。
附:常见离子的检验
|
离子 |
所用试剂或操作 |
现象 |
相关方程式 |
|
NH4+ |
加浓碱液、△ |
产生刺激性气味气体,且使湿润红色石蕊试纸变蓝 |
NH4+ + OH– NH3↑+ H2O NH3↑+ H2O |
|
Mg2+ |
加过量NaOH溶液 |
产生白色沉淀 |
Mg2+ + 2OH– = Mg(OH)2↓ |
|
Al3+ |
加过量氨水,后加NaOH |
产生白色沉淀,加NaOH时沉淀溶解 |
Al3++3NH3•H2O = Al(OH)3↓+3NH4+ Al(OH)3+ OH–= [Al(OH)4]-+ 2H2O |
|
Fe2+ |
加NaOH溶液 |
产生白色沉淀,后迅速变灰绿,最终变红褐色沉淀 |
Fe2+ + 2OH– = Fe (OH)2↓ 4Fe (OH)2 + O2 + 2H2O = 4Fe (OH)3 |
|
Fe3+ |
加KSCN溶液 |
溶液变血红色 |
Fe3+ + SCN– = [Fe(SCN)]2+ |
|
Ag+ |
加NaCl溶液,后加稀HNO3 |
产物白色↓,加稀HNO3后不溶 |
Ag+ + Cl– = AgCl↓ |
|
Cl– |
加稀HNO3酸化的AgNO3溶液 |
产生白色沉淀 |
Ag+ + Cl– =
AgCl↓ |
|
Br– |
加稀HNO3酸化的AgNO3溶液 |
产生淡黄色沉淀 |
Ag+ + Br– =
AgBr↓ |
|
I– |
加稀HNO3酸化的AgNO3溶液 |
产生黄色沉淀 |
Ag+ + I– =AgI↓ |
|
SO42– |
加HCl酸化的BaCl2 |
产生白色沉淀 |
Ba2++SO42–= BaSO4↓ |
|
SO32– |
加盐酸后,产生气体,通入品红试液,加热 |
产生无色刺激性气味气体,且使品红试液褪色,加热后恢复原色 |
2H++ SO32–=SO2↑+H2O |
|
NO3– |
加Cu和浓H2SO4,加热浓缩 |
产生红棕色气体,溶液变蓝 |
Cu+2H2SO4(浓)+2NaNO3 CuSO4+Na2SO4+2NO2↑+2H2O CuSO4+Na2SO4+2NO2↑+2H2O |
|
PO43– |
加AgNO3溶液,后加稀HNO3 |
产生黄沉淀,加酸后沉淀溶解 |
3Ag++ PO43–=
Ag3PO4↓Ag3PO4+3H+=3Ag++H3PO4 |
|
CO32– |
加盐酸后,产生的气体通入澄清石灰水 |
产生无色气体,此气体能使澄清石灰水变浑浊 |
2H++CO32–=CO2↑+H2O Ca2++2OH–+CO2=CaCO3↓+H2O |
|
HCO3– |
加热,产生的气体通入澄清石灰水 |
产生无色气体,此气体能使澄清石灰水变浑浊 |
2NaHCO3 Na2CO3+CO2↑+H2O Ca2++2OH–+CO2=CaCO3↓+H2O Na2CO3+CO2↑+H2O Ca2++2OH–+CO2=CaCO3↓+H2O |
(2)物质的制备与纯化
(3)生活中的应用
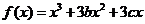 有两个极值点
有两个极值点
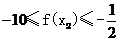
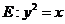 与圆
与圆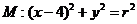
 相交于
相交于 四个点。
四个点。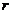 的取值范围:
的取值范围:

 的面积最大时,求对角线
的面积最大时,求对角线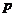 的坐标。
的坐标。 ,DC=SD=2.点M在侧棱SC上,∠ABM=60
,DC=SD=2.点M在侧棱SC上,∠ABM=60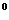 .
.
 表示从第3局开始到比赛结束所进行的局数,求
表示从第3局开始到比赛结束所进行的局数,求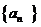 中,
中, 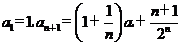 .
.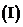 设
设 ,求数列
,求数列 的通项公式;
的通项公式;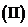 求数列
求数列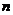 项和
项和 .
.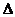 ABC中,内角A、B、C的对边长分别为a、b、c ,已知
ABC中,内角A、B、C的对边长分别为a、b、c ,已知
 ,且
,且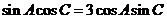 ,求b.
,求b. 的展开式中,
的展开式中,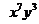 的系数与
的系数与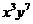 的系数之和等于
.
的系数之和等于
.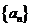 的前n项和为
的前n项和为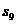 =72,则
=72,则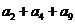 =
.
=
.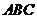 -
-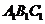 各顶点都在同一球面上.若
各顶点都在同一球面上.若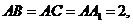 ∠
∠ =
= ,则此球的表面积等于
.
,则此球的表面积等于
.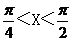 ,则函数
,则函数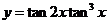 的最大值为
.
的最大值为
. B,则集合
B,则集合 (A
(A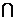 B)中的元素共有
B)中的元素共有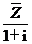 =2+I,则复数z=
=2+I,则复数z=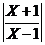 <1的解集为
<1的解集为 (B)
(B)
 (D)
(D)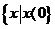
 (a>0,b>0)的渐近线与抛物线y=x2 +1相切,则该双曲线的离心率等于
(a>0,b>0)的渐近线与抛物线y=x2 +1相切,则该双曲线的离心率等于 (B)2
(C)
(B)2
(C)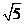 (D)
(D)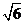
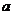 、
、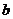 、
、 是单位向量,且
是单位向量,且 的最小值为
的最小值为 (B)
(B) (C)
(C) (D)
(D)
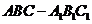 的侧棱与底面边长都相等,
的侧棱与底面边长都相等,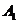 在底面
在底面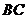 的中点,则异面直线
的中点,则异面直线 与
与 所成的角的余弦值为
所成的角的余弦值为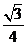 (B)
(B)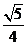 (C)
(C)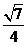 (D)
(D) 
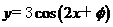 的图像关于点
的图像关于点 中心对称,那么
中心对称,那么 的最小值为
的最小值为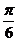 (B)
(B)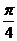 (C)
(C) (D)
(D) 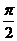
 相切,则α的值为
相切,则α的值为 ,则P、Q两点之间距离的最小值为
,则P、Q两点之间距离的最小值为 的定义域为R,若
的定义域为R,若 与
与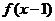 都是奇函数,则
都是奇函数,则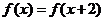 (D)
(D)
 是奇函数
是奇函数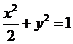 的又焦点为F,右准线为L,点
的又焦点为F,右准线为L,点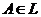 ,线段AF 交C与点B。若
,线段AF 交C与点B。若 ,则
,则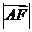 =
= 选修Ⅱ)
选修Ⅱ)