|
|
强
电 解 质 |
弱
电 解 质 |
|
概念 |
在水溶液中全部电离成离子的电解质 |
在水溶液中只有一部分电离成离子的电解质 |
|
电离程度 |
完全 |
部分 |
|
溶液里粒子 |
水合离子 |
水合分子、水合离子 |
|
物质结构 |
离子化合物、某些共价化合物 |
某些共价化合物 |
|
与常见物质类别的关系 |
通常为 强酸:HCl、H2SO4、HNO3等 强碱:NaOH、KOH、Ba(OH)2等 绝大多数盐:NaCl、CaCO3、CH3COONa等 |
通常为 弱酸:CH3COOH、HF、HClO、H2S、H2CO3、H2SiO3、H4SiO4等 弱碱:NH3·H2O、Cu(OH)2等 极少数盐、水 |
根据化合物在水溶液或熔化状态下能否导电,可将其划分为电解质、非电解质。电解质有强、弱之分,强电解质、弱电解质的本质区别在于它们在溶液中的电离程度不同。电解质在水中的溶解程度和电离程度可能不一致,在水中溶解程度大的不一定是强电解质(如醋酸),在水中溶解程度小的不一定是弱电解质(如硫酸钡)。
|
|
电 解 质 |
非
电 解 质 |
|
定
义 |
在水溶液中或熔化状态下能导电的化合物 |
在水溶液中和熔化状态下都不导电的化合物 |
|
相同点 |
都是与溶解性无关的化合物 |
|
|
不同点 |
在一定条件下能电离 |
不能电离 |
|
在水溶液中或熔化状态下能导电 |
在水溶液中和熔化状态下都不导电 |
|
|
与常见物质类别的关系 |
离子化合物和部分共价化合物 |
全是共价化合物 |
|
通常为酸、碱、盐、水、典型金属氧化物、某些非金属氢化物等 |
通常为非金属氧化物、某些非金属氢化物、绝大多数有机物等 |
例1.下列物质属于电解质的是( )
A.SO2 B.Cu C.氨水 D.NaCl E.NaOH F.HCl G.酒精 H.AgCl
解析:电解质应该是化合物,铜(单质)、氨水(混合物)不是电解质;电解质的导电条件是在水溶液里或熔化状态下,氯化银虽然其水溶液几乎不导电,但在熔化状态下导电,因此它是电解质;电解质导电必须是用化合物本身电离出自由移动的离子而导电,不能是发生化学反应生成的物质导电,如二氧化硫水溶液导电,是由于二氧化硫与水反应生成的亚硫酸能导电,所以二氧化硫不是电解质;蔗糖、酒精等化合物,无论是固态或其水溶液都不导电,这些化合物是非电解质。
答案:D、E、F、H。
 [Fe(SCN)]2+;能水解的阳离子跟能水解的阴离子(如Al3+和HCO3-、CO32-、HS-、S2-、ClO-)在水溶液中也能发生反应等。
[Fe(SCN)]2+;能水解的阳离子跟能水解的阴离子(如Al3+和HCO3-、CO32-、HS-、S2-、ClO-)在水溶液中也能发生反应等。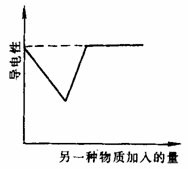 与金属的导电原理(通过内部自由电子的定向移动)不同,电解质溶液之所以能够导电,是因为溶液中存在自由移动的离子;在一定浓度范围内,溶液导电能力的强弱与溶液中离子的浓度有关:离子浓度越高,溶液的导电能力越强。
与金属的导电原理(通过内部自由电子的定向移动)不同,电解质溶液之所以能够导电,是因为溶液中存在自由移动的离子;在一定浓度范围内,溶液导电能力的强弱与溶液中离子的浓度有关:离子浓度越高,溶液的导电能力越强。 ":
":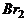 发生加成反应,产生二溴衍生物B;B用热的NaOH-乙醇溶液处理得到化合物C;经测试知C的结构中含有两个双键,化学式是
发生加成反应,产生二溴衍生物B;B用热的NaOH-乙醇溶液处理得到化合物C;经测试知C的结构中含有两个双键,化学式是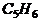 ;将C催化加氢生成环戊烷。写出A、B、C的结构式。
;将C催化加氢生成环戊烷。写出A、B、C的结构式。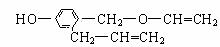 C.取代-加成-消去
D.消去-加成-取代
C.取代-加成-消去
D.消去-加成-取代