摘要:若从H2SO4.Na2CO3.Na2SO4.NaCl.NaNO3.Cu(NO3)2.HNO3七种溶液中取出其中的两种.进行混合及有关实验.所观察到的现象记录如下表.试根据各步实验和现象先进行分步推断.再推断所取的两种溶液的可能组合.步骤实 验 操 作实 验 现 象推 断(1)将取出的两种溶液混合混合溶液无色.澄清混合液中肯定不含Cu(NO3)2无明显现象混合液肯定不是下列组合:(2)用PH试纸测定混合液的PH测定结果:PH=2 (3)向混合液中滴入足量Ba(NO3)2溶液有白色沉淀出现 (4)向上述过滤所得滤液中滴加AgNO3溶液无明显现象 混合溶液的可能组合(写出溶质的化学式.有几组写几组)① ② ③ ④
网址:http://m.1010jiajiao.com/timu_id_99577[举报]
若从H2SO4、Na2SO4、Na2CO3、NaCl、NaOH、Cu(NO3)2、HNO3 7种溶液中取出其中的2种,进行混合及有关实验,所观察到的现象已记录在下表中。试据各步实验及其现象先进行分步推断(即实验进行到该步所能作出的某物质肯定存在、否定存在或可能存在的判断),再综合推断所取出的2种溶液的可能组合。
步骤 | 实验操作 | 实验现象 | 分步推断 |
⑴ | 将取出的2种溶液进行混合 | 混合溶液无色、澄清 无其他明显现象 | 混合溶液中肯定不含Cu(NO3)2 混合溶液肯定不是下列组合:
|
⑵ | 用pH试纸测定混合溶液的pH | 测定结果:pH=2 | |
⑶ | 向混合溶液中滴入足量Ba(NO3)2溶液 | 有白色沉淀出现 | |
⑷ | 向上述溶液过滤所得的滤液中滴加AgNO3 | 无明显现象 |
混合溶液的可能组合(写出溶质的化学式,有几组写几组,不一定填满,):
① 和 ;② 和 ;③ 和 ;
④ 和 ;⑤ 和 ;⑥ 和 ;
查看习题详情和答案>> 分别回答下列问题.
分别回答下列问题.(1)从H+、Na+、Cu2+、Cl-、S
| O | 2- 4 |
①电解过程中溶液颜色变浅且水量不变
CuCl2
CuCl2
;②电解过程中电解质含量不变,水量减少
H2SO4或Na2SO4
H2SO4或Na2SO4
;③电解过程中,两极析出气体的体积比为1:1
HCl或NaCl
HCl或NaCl
.(2)①用惰性电极电解硫酸铜溶液,若阴极上有1.6克铜析出,则阳极上产生的气体在标准状况下的体积约为
0.28L
0.28L
;②用铂电极电解0.02mol/L硫酸铜溶液,直至铜完全析出,所得溶液中氢离子浓度为(忽略溶液体积的变化)
0.04mol/L
0.04mol/L
;③已知下列两个热化学方程式2H2(g)+O2(g)=2H2O(1)△H=-571.6KJ;C3H8(g)+5O2(g)=3CO2(g)+4H2O(1)△H=-2220.0kJ实验测得,5mol氢气和丙烷的混合气体完全燃烧时放热3847kJ,则混合气体中氢气与丙烷的体积比是
3:1
3:1
.(3)如图所示,甲、乙两试管中各放一枚铁钉,甲试管中为NaCl溶液,乙试管为稀醋酸溶液,数天后观察到的现象
是
U形管左端液面上升,右边液面下降
U形管左端液面上升,右边液面下降
,甲中正极反应为O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
,乙中正极反应为2H++2e-=H2↑
2H++2e-=H2↑
.下列说法错误的是( )
| A、氢氧化钠固体应盛放在带橡胶塞的广口试剂瓶中 | B、实验室活泼金属K、Ca、Na起火,不能用水灭火 | C、若浓H2SO4不慎溅入眼睛,应立即用浓NaOH中和并用大量水冲洗 | D、圆底烧瓶不能在酒精灯上直接加热,应垫石棉网 |
以下是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色.
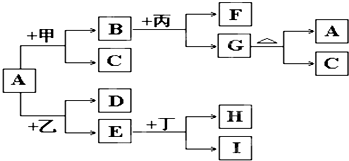
(1)若F是由Na+和SO42-组成的溶液,则甲的化学式是
(2)若D是能使澄清石灰水变浑浊的气体,则乙的化学式为
(3)写出G→A+C的化学方程式:
(4)若A中混有杂质Al2O3,除去杂质的方法是加入过量的
(5)由E和A组成的混合物与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1.则反应物中Fe2O3、Fe、H2SO4的物质的量之比为
查看习题详情和答案>>

(1)若F是由Na+和SO42-组成的溶液,则甲的化学式是
H2SO4
H2SO4
,列举A物质的一种用途用作红色油漆和涂料
用作红色油漆和涂料
.(2)若D是能使澄清石灰水变浑浊的气体,则乙的化学式为
CO
CO
,丁属于单质、酸、碱中的酸
酸
;在I溶液中加入氢氧化钠溶液,可以观察到的现象是生成白色沉淀,迅速变为灰绿色,最终变为红褐色
生成白色沉淀,迅速变为灰绿色,最终变为红褐色
,对应的离子方程式和化学方程式依次是Fe2++2OH-=Fe(OH)2↓
Fe2++2OH-=Fe(OH)2↓
,4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
;(3)写出G→A+C的化学方程式:
2Fe(OH)3
Fe2O3+3H2O
| ||
2Fe(OH)3
Fe2O3+3H2O
.
| ||
(4)若A中混有杂质Al2O3,除去杂质的方法是加入过量的
NaOH溶液
NaOH溶液
,该反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
.(5)由E和A组成的混合物与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1.则反应物中Fe2O3、Fe、H2SO4的物质的量之比为
1:2:4
1:2:4
.(2011?江西一模)[化学与技术]硫酸工业生产应考虑综合经济效益问题.
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1t 98%硫酸需消耗3.6×105kJ能量.请通过计算判断,若反应:SO2(g)+
O2?SO3 △H=-98.3kJ?mol-1放出的热量能在生产过程中得到充分利用,则每生产1t98%硫酸只需外界提供(或可向外界输出)
(3)CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因
查看习题详情和答案>>
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在
C
C
的郊区(填选项的标号)A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1t 98%硫酸需消耗3.6×105kJ能量.请通过计算判断,若反应:SO2(g)+
| 1 |
| 2 |
6.23×105
6.23×105
千焦能量(H2SO4的摩尔质量为98g?mol-1)(3)CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为
4CuFeS2+13O2
4CuO+2Fe2O3+8SO2
| ||
4CuFeS2+13O2
4CuO+2Fe2O3+8SO2
.
| ||
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 矿渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡逆移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少)
SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡逆移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少)
.