摘要:(8)若称取粗盐m1g.最后得精盐m2g.则该粗盐的纯度为.试评价这一计算结果的正确性.
网址:http://m.1010jiajiao.com/timu_id_99573[举报]
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
称取粗盐
滤液
精盐
(1)判断BaCl2已过量的方法是
(2)加入NaOH溶液的目的是
(3)第④步中,相关的化学方程式是
(4)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是
查看习题详情和答案>>
称取粗盐
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸蒸发 |
| ⑥ |
| 结晶烘干 |
| ⑦ |
(1)判断BaCl2已过量的方法是
取第②步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量
取第②步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量
.(2)加入NaOH溶液的目的是
溶液中存在的 Mg2+和 Fe3+ 完全转化为沉淀除去
溶液中存在的 Mg2+和 Fe3+ 完全转化为沉淀除去
.(3)第④步中,相关的化学方程式是
Ca2++CO32-═CaCO3↓、Ba2++CO32-═BaCO3↓
Ca2++CO32-═CaCO3↓、Ba2++CO32-═BaCO3↓
.(4)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是
在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
. 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)称取粗盐
| ①溶解 |
| ②BaCl2 |
| ③NaOH |
| ④Na2CO3 |
| ⑤过滤 |
| ⑥适量盐酸 |
| ⑦结晶、烘干 |
(1)判断BaCl2已过量的方法是
(2)第④步中,相关的离子方程式是
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是
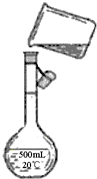
(4)为检验精盐纯度,特配制150mL 0.2mol?L-1 NaCl溶液,如图是该同学转移溶液的示意图,图中的错误是
(5)提纯过程中步骤①⑤⑦都用到相同的仪器,名称:
 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下所示(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下所示(用于沉淀的试剂稍过量):称取粗盐
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
(1)判断BaCl2已过量的方法是
取第②步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量
取第②步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量
.(2)第④步中,相关的离子方程式是
Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓
Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓
.(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是
在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
.(4)为检验精盐纯度,制配制 100mL 0.2mol/L NaCl(精盐)溶液,如图所示是该同学转移溶液的示意图,图中的错误是
未用玻璃棒引流,未采用100mL容量瓶
未用玻璃棒引流,未采用100mL容量瓶
.为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
称取粗盐
滤液
精盐
(1)步骤②中应加入的试剂是
(2)步骤④中应加入的试剂是
(3)若将第⑤步和第⑥步颠倒,会对实验结果产生影响,其原因是
查看习题详情和答案>>
称取粗盐
| ||
| ① |
| ② |
| ||
| ③ |
| ④ |
| ||
| ⑤ |
| ||
| ⑥ |
| ||
| ⑦ |
(1)步骤②中应加入的试剂是
BaCl2
BaCl2
溶液,判断此试剂已加过量的方法是取少量上层澄清液于试管中,滴加氯化钡溶液,不再产生白色沉淀,证明氯化钡溶液已滴加过量或取少量上层澄清液于试管中,滴加稀硫酸,产生白色沉淀,证明氯化钡溶液已滴加过量
取少量上层澄清液于试管中,滴加氯化钡溶液,不再产生白色沉淀,证明氯化钡溶液已滴加过量或取少量上层澄清液于试管中,滴加稀硫酸,产生白色沉淀,证明氯化钡溶液已滴加过量
.(2)步骤④中应加入的试剂是
Na2CO3
Na2CO3
溶液,第④步中相关的离子方程式是Ca2++CO32-═CaCO3↓、Ba2++CO32-═BaCO3↓
Ca2++CO32-═CaCO3↓、Ba2++CO32-═BaCO3↓
.(3)若将第⑤步和第⑥步颠倒,会对实验结果产生影响,其原因是
会使CaCO3、BaCO3、Mg(OH)2沉淀溶解,重新引入Ca2+、Ba2+、Mg2+
会使CaCO3、BaCO3、Mg(OH)2沉淀溶解,重新引入Ca2+、Ba2+、Mg2+
. 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):称取粗盐
| ||
| ① |
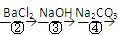
| ||
| ⑤ |
| ||
| ⑥ |
| ||
| ⑦ |
(1)判断BaCl2已过量的方法是
取第②步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量
取第②步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量
.(2)第④步中,相关的离子方程式是
Ca2++CO32-=CaCO3↓
Ca2++CO32-=CaCO3↓
;Ba2++CO32-=BaCO3↓
Ba2++CO32-=BaCO3↓
.(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
.(4)为检验精盐纯度,需配制150mL 0.2mol?L-1NaCl(精盐)溶液,右图是该同学转移溶液的示意图,图中的错误是
未用玻璃棒引流,未采用150mL容量瓶
未用玻璃棒引流,未采用150mL容量瓶
.