摘要:29.化学在能源开发与利用中起着十分关键的作用. (1)蕴藏在海底的“可燃冰 是高压下形成的外观象冰的甲烷水合物固体.甲烷气体燃烧和水汽化的热化学方程式为:
网址:http://m.1010jiajiao.com/timu_id_94709[举报]
一、选择题(每小题只有一个选项符合题意,每小题4分,共64分)
1―5 CCBDC 6―10 CDDDD 11―15 CBBCB
二、选择题(每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得4分,选对但不全的得2分,有选错或不答的得0分)
16.A 17.ABC 18.BD 19.AD 20.B 21.AC 22.C
【必做部分】
23.(12分)
(1)用A2替换A1(2分)待测电阻约2kΩ,用3.7V电池供电时最大电流约
 ,因此电流表用A1量程太大,换用A2。(3分)
,因此电流表用A1量程太大,换用A2。(3分)

 (3分)
(3分) (1分)
(1分) (2分)
(2分) (1分)
(1分) (3分)
(3分) (3分)
(3分) (2分)
(2分)
 ,则:
,则: …………① (2分)
…………① (2分) …………② (1分)
…………② (1分) ………………③ (2分)
………………③ (2分) …………④ (2分)
…………④ (2分) (1分)
(1分)
 …………⑤ (2分)
…………⑤ (2分) …………⑥ (2分)
…………⑥ (2分)
 (2分)
(2分)

 ……1分
……1分

 (2分)
(2分) (1分)
(1分) (2分)
(2分) (2分)
(2分) (1分)
(1分) 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
 烷气体完全燃烧生成液态水.放出的热量为
烷气体完全燃烧生成液态水.放出的热量为 Cu2O+H2
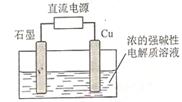
Cu2O+H2 。该电解池中,铜电极接直流电源的 极;每生成1molCu2O,电路中通过的电子的数目为 ;该电解
。该电解池中,铜电极接直流电源的 极;每生成1molCu2O,电路中通过的电子的数目为 ;该电解 池的阴极反应式为 。
池的阴极反应式为 。