网址:http://m.1010jiajiao.com/timu_id_916272[举报]
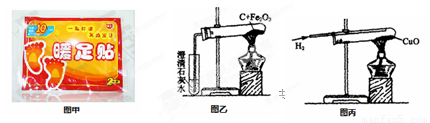
 生活离不开金属,如图是生活中某“取暖片”的外包装.该“取暖片”中发热剂的主要成分是铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热的原理.发热剂需要接触到空气才会发热,原因是铁要与
生活离不开金属,如图是生活中某“取暖片”的外包装.该“取暖片”中发热剂的主要成分是铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热的原理.发热剂需要接触到空气才会发热,原因是铁要与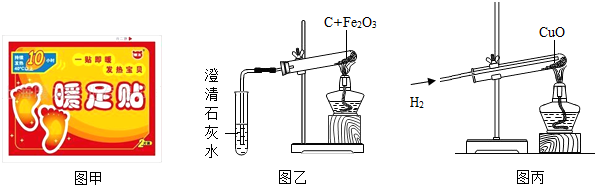
(1)发热剂需接触到空气才会发热,原因是铁要与
(2)试推测发热剂成分氯化钠的作用是
(3)打开用过的“暖足贴”,兴趣小组的同学们发现原先黑色的铁粉颜色变成了红棕色.他们想到了金属的回收及利用的重要性,考虑能否用学过的知识将之还原成铁粉.于是,他们在实验室找来炭粉及Fe2O3粉末,在做完图乙所示实验后,发现澄清石灰水变浑浊,试管中粉末全部变为黑色.A组一同学将黑色粉末倒在纸上,发现纸竟然烧起来了,原因是
(4)B组同学在正确操作之后,取少量黑色粉末,加入足量稀硫酸充分振荡,但她惊讶地发现黑色粉末没有溶解,试管中也未产生预期的气泡,这说明该反应并没有生成
(5)A、B组同学查阅资料,得到关于铁的氧化物相关信息如下:
| 铁的氧化物 | Fe2O3 | Fe3O4 | FeO |
| 颜色 | 红色 | 黑色 | 黑色 |
| 化学性质 | 可溶于稀硫酸 | 常温下不溶于稀硫酸 | 可溶于稀硫酸 |
| ||
| ||
(6)两组同学联想到还原性气体H2,通过继续查阅资料发现酒精灯火焰的温度在600℃左右,而H2还原氧化铜所需温度大约在250℃,他们按图丙所示进行实验,看到了预期现象,写出试管中反应的方程式
| ||
| ||

(2)“取暖片”中的氯化钠作用是__________(填序号)
①溶于水放热 ②加快铁生锈 ③没有任何用途
(3)化学兴趣小组的甲、乙二位同学对“取暖片”的成分产生了兴趣。
Ⅰ.甲同学测定新的“取暖片”中铁粉的含量。取5.7g“取暖片”样品,投入装有10.0g稀盐酸(足量)的烧杯(烧杯质量10.0g)中。在化学反应过程中对烧杯进行了五次称量,数据记录如下表:
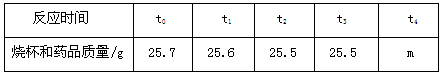
②5.7g “取暖片”样品中铁粉的质量为___________克
Ⅱ.乙同学测定一包已变质“取暖片”中Fe2O3的质量分数。取10g已变质“取暖片”样品与过量的木炭粉混合,如下图所示装置完成实验。

②充分反应后,乙同学测定b中的试剂增加了3.3g,b中的试剂是__________溶液,发生反应的化学方程式为_____________。
③请帮乙同学求出已变质的“取暖片”样品中Fe2O3的质量分数_____________。
铁是生活中常用的金属,下图是某“取暖片”外包装的图片。该“取![]() 暖片”中发热剂主要成分有铁粉、氯化钠、水、活性炭等,其发热是利用铁生锈时会放热的原理。
暖片”中发热剂主要成分有铁粉、氯化钠、水、活性炭等,其发热是利用铁生锈时会放热的原理。
(1)发热剂需接触到空气才会发热,原因是铁要与 共同作用才会生锈。

(2)“取暖片”中的氯化钠作用是 (填序号)
①溶于水放热 ②加快铁生锈 ③没有任何用途
(3)化学兴趣小组的甲、乙二位同学对“取暖片”的成分产生了兴趣。
Ⅰ.甲同学测定新的“取暖片”中铁粉的含量。取5.7g“取暖片”样品,投入装有10.0g稀盐酸(足量)的烧杯(烧杯质量10.0g)中。在化学反应过程中对烧杯进行了五次称量,数据记录如下表:
| 反应时间 | t0 | t1 | t2 | t3 | t4 |
| 烧杯和药品质量/g | 25.7 | 25.6 | 25.5 | 25.5 | m |
①表格中m的值为 克;
②5.7g “取暖片”样品中铁粉的质量为 克
Ⅱ.乙同学测定一包已变质“取暖片”中Fe2O3的质量分数。取10g已变质“取暖片”样品与过量的木炭粉混合,如下图所示装置完成实验。

①实验中加热前要缓缓通入一段时间氮气,作用是 。停止加热后还要![]() 缓缓通入一段时间氮气,否则会导致测定的结果 (填“偏大”、“偏小”)。
缓缓通入一段时间氮气,否则会导致测定的结果 (填“偏大”、“偏小”)。
②充分反应后,乙同学![]() 测
测![]() 定b中的试剂增加了3.3g,b中的试剂是 溶液,发生反应的化学方程式为 。
定b中的试剂增加了3.3g,b中的试剂是 溶液,发生反应的化学方程式为 。
③请帮乙同学求出已变质的“取暖片”样品中Fe2O3的质量分数。
查看习题详情和答案>>“暖足贴”利用铁氧化生锈时会放热的原理从而达到给人局部热敷的作用,具有一贴即热,快速热敷的作用,深受大众的喜爱。下图甲是某品牌“暖足贴”的图片。A、B两小组的同学,通过查阅资料发现,其主要成份为:铁粉、活性炭、水、食盐等物质。
[来源:Z.xx.k.Com]
(1)发热剂需接触到空气才会发热,原因是铁要与 、 等物质共同作用才会生锈,铁生锈发生氧化反应,放出热量。
(2)试推测发热剂成分氯化钠的作用是 ,从而更快的放出热量;“暖足贴”的发热还应用了活性炭具有 性。
(3)打开用过的“暖足贴”,兴趣小组的同学们发现原先黑色的铁粉颜色变成了红棕色。他们想到了金属的回收及利用的重要性,考虑能否用学过的知识将之还原成铁粉。于是,他们在实验室找来炭粉及Fe2O3粉末,在做完图乙所示实验后,发现澄清石灰水变浑浊,试管中粉末全部变为黑色。
A组一同学将黑色粉末倒在纸上,发现纸竟然烧起来了,原因是 ;另一同学立即用一块湿抹布进行扑盖,火马上熄灭,试说明灭火原理 。
(4)B组同学在正确操作之后,取少量黑色粉末,加入足量稀硫酸充分振荡,但她惊讶地发现黑色粉末没有溶解,试管中也未产生预期的气泡,这说明该反应并没有生成 。
(5)A、B组同学查阅资料,得到关于铁的氧化物相关信息如下:
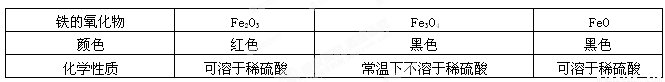 根据以上信息,试写出图乙实验中炭粉与Fe2O3发生反应的化学方程式
根据以上信息,试写出图乙实验中炭粉与Fe2O3发生反应的化学方程式
经分析后,A、B同学试着提高反应温度后,实验出现了预期的现象。
(6)两组同学联想到还原性气体H2,通过继续查阅资料发现酒精灯火焰的温度在600℃左右,而H2还原氧化铜所需温度大约在250℃,他们按图丙所示进行实验,看到了预期现象,写出试管中反应的方程式 。
查看习题详情和答案>>