摘要:②CH3CHO+2Ag[(NH3)2OH] CH3COONH4 + 2Ag↓+ 3NH3 +2H2O.
网址:http://m.1010jiajiao.com/timu_id_90590[举报]
由本题所给的①、②两条信息,结合已学知识,回答下列问题.
①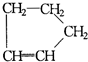 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 ,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基(
,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基( ),这两步反应合在一起,称为“烯键的臭氧分解”.例如:
),这两步反应合在一起,称为“烯键的臭氧分解”.例如:


(1)写出异戊二烯臭氧分解的各种产物的结构简式
(2)a mol某烃CnH2n-2(该分子中无-C≡C-)和 结构),发生臭氧分解后,测得有机产物中含有羰基(
结构),发生臭氧分解后,测得有机产物中含有羰基( )b mol,则a和b的代数关系是:
)b mol,则a和b的代数关系是:
(3)写出由环己醇( )和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式
)和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式
(4)某烃A的化学式为C10H16,A经臭氧分解可得到等物质的量的两种产物,其结构简式分别为HCHO和 .A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A
.A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A
 ,B
,B
 .
.
(5)从香精油中分离到一种化合物[A](C10H16),1mol[A]在催化加氢时可吸收2mol氢气;1mol[A]经臭氧氧化反应再加锌粉水解可得到1mol丙酮[(CH3)2C=O]和1mol3,6-二羰基庚醛 ,则推测得[A]的结构式为
,则推测得[A]的结构式为

 .
.
(6)一定量的化学式均为C4H8的不饱和烃的混合气体,经臭氧分解后生成8.7g酮、0.45mol的醛(其中甲醛有0.21mol).试通过计算回答下列问题:
(a)氧化后生成哪些物质?写出结构简式
(b)混合气体中含哪几种烃(写结构简式)?其物质的量之比为多少?
查看习题详情和答案>>
①
 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 ,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基(
,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基( ),这两步反应合在一起,称为“烯键的臭氧分解”.例如:
),这两步反应合在一起,称为“烯键的臭氧分解”.例如:

(1)写出异戊二烯臭氧分解的各种产物的结构简式
HCHO、

HCHO、
,它们的物质的量之比为
2:1
2:1
.(2)a mol某烃CnH2n-2(该分子中无-C≡C-)和
 结构),发生臭氧分解后,测得有机产物中含有羰基(
结构),发生臭氧分解后,测得有机产物中含有羰基( )b mol,则a和b的代数关系是:
)b mol,则a和b的代数关系是:b=4a
b=4a
或b=2a
b=2a
.(3)写出由环己醇(
 )和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式
)和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式① 、
、
② 、
、
③ 、
、
④
 、
、②
 、
、③
 、
、④

① 、
、
② 、
、
③ 、
、
④
. 、
、②
 、
、③
 、
、④

(4)某烃A的化学式为C10H16,A经臭氧分解可得到等物质的量的两种产物,其结构简式分别为HCHO和
 .A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A
.A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A



(5)从香精油中分离到一种化合物[A](C10H16),1mol[A]在催化加氢时可吸收2mol氢气;1mol[A]经臭氧氧化反应再加锌粉水解可得到1mol丙酮[(CH3)2C=O]和1mol3,6-二羰基庚醛
 ,则推测得[A]的结构式为
,则推测得[A]的结构式为 

(6)一定量的化学式均为C4H8的不饱和烃的混合气体,经臭氧分解后生成8.7g酮、0.45mol的醛(其中甲醛有0.21mol).试通过计算回答下列问题:
(a)氧化后生成哪些物质?写出结构简式
CH3CH2CHO、CH3CHO、HCHO、(CH3)2CO
CH3CH2CHO、CH3CHO、HCHO、(CH3)2CO
.(b)混合气体中含哪几种烃(写结构简式)?其物质的量之比为多少?
(CH3)2C=CH2、CH3CH2CH=CH2、CH3CH=CHCH3
(CH3)2C=CH2、CH3CH2CH=CH2、CH3CH=CHCH3
,5:2:3
5:2:3
.把300ml有BaCl2和AlCl3的混合溶液分成3等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入等体积4bmol/L氢氧化钠溶液,恰好使产生的沉淀溶解.则该混合溶液中氯离子浓度为( )
| A、20a+3b | B、20a/3+b | C、2a+3b | D、10a+2b |
某温度(t℃)时,在2L密闭容器内发生反应:2A (g)+B(g)?2C(g)体系中n(A)随时间的变化如下表:
请回答:
(1)用A浓度变化表示从0~2s内该反应的平均速率v=
(2)能说明该反应已达到化学平衡状态的是
①容器内压强保持不变 ②A的物质的量保持不变
③容器内密度保持不变 ④消耗2mol A的同时,消耗1mol B
(3)温度升高,A的转化率减小,则该正反应是
(4)若开始时充入B的物质的量是A的一半,则t℃时平衡常数K的数值是
查看习题详情和答案>>
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| n(A)/mol | 2.0 | 1.0 | 0.8 | 0.8 | 0.8 |
(1)用A浓度变化表示从0~2s内该反应的平均速率v=
0.3
0.3
mol/(L?s).(2)能说明该反应已达到化学平衡状态的是
①②
①②
(填序号).①容器内压强保持不变 ②A的物质的量保持不变
③容器内密度保持不变 ④消耗2mol A的同时,消耗1mol B
(3)温度升高,A的转化率减小,则该正反应是
放热
放热
(填“吸热”或“放热”)反应.(4)若开始时充入B的物质的量是A的一半,则t℃时平衡常数K的数值是
11.25
11.25
.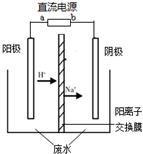 (2012?海淀区二模)最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、电解阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O═CH3CH2OH+CH3COOH实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示.
(2012?海淀区二模)最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、电解阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O═CH3CH2OH+CH3COOH实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示.(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入
CH4
CH4
(填化学式)气体.(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体.电极反应如下:
阳极:①4OH--4e-═O2↑+2H2O
②
CH3CHO-2e-+H2O═CH3COOH+2H+
CH3CHO-2e-+H2O═CH3COOH+2H+
阴极:①
4H++4e-═2H2↑或4H2O+4e-═2H2↑+4OH-
4H++4e-═2H2↑或4H2O+4e-═2H2↑+4OH-
②CH3CHO+2e-+2H2O═CH3CH2OH+2OH-
(3)电解过程中,阴极区Na2SO4的物质的量
不变
不变
(填“增大”、“减小”或“不变”).(4)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同.下列关于阳极区溶液中各微粒浓度关系的说法正确的是
abd
abd
(填字母序号).a.c(Na+)不一定是c(SO42-)的2倍
b.c(Na+)=2c(CH3COOH)+2c(CH3COO-)
c.c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)
d.c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(5)已知:乙醛、乙醇的沸点分别为20.8℃、78.4℃.从电解后阴极区的溶液中分离出乙醇粗品的方法是
蒸馏
蒸馏
.(6)在实际工艺处理中,阴极区乙醛的去除率可达60%.若在两极区分别注入1m3乙醛的含量为3000mg/L的废水,可得到乙醇
1.9
1.9
kg(计算结果保留小数点后1位).在三种不同条件下,分别向容积为2L的恒容容器中加入2mol A和1mol B,发生反应如下:2A(g)+B(g)?2D(g)△H=Q kJ?mol-1,相关条件和数据见下表.下列说法正确的是( )
| 实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
| 反应温度/℃ | 800 | 800 | 850 |
| 达到平衡所需时间/min | 40 | a | 30 |
| D物质平衡浓度/mol?L-1 | 0.5 | b | 0.6 |
| 反应的能量变化/kJ | Q1 | Q2 | Q3 |
| A、当容器中气体的相对分子质量不再发生变化时,说明该反应达到平衡状态 |
| B、如果实验Ⅱ相比实验Ⅰ使用了催化剂,则a>40,b=0.5 |
| C、实验Ⅲ达到平衡时,向其中通入少量惰性气体,容器压强增大,平衡向右移动 |
| D、由表中信息可知Q<0,并且有Q1=Q2<Q3 |