题目内容
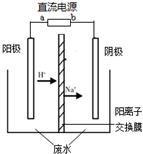 (2012?海淀区二模)最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、电解阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O═CH3CH2OH+CH3COOH实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示.
(2012?海淀区二模)最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、电解阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O═CH3CH2OH+CH3COOH实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示.(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入
CH4
CH4
(填化学式)气体.(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体.电极反应如下:
阳极:①4OH--4e-═O2↑+2H2O
②
CH3CHO-2e-+H2O═CH3COOH+2H+
CH3CHO-2e-+H2O═CH3COOH+2H+
阴极:①
4H++4e-═2H2↑或4H2O+4e-═2H2↑+4OH-
4H++4e-═2H2↑或4H2O+4e-═2H2↑+4OH-
②CH3CHO+2e-+2H2O═CH3CH2OH+2OH-
(3)电解过程中,阴极区Na2SO4的物质的量
不变
不变
(填“增大”、“减小”或“不变”).(4)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同.下列关于阳极区溶液中各微粒浓度关系的说法正确的是
abd
abd
(填字母序号).a.c(Na+)不一定是c(SO42-)的2倍
b.c(Na+)=2c(CH3COOH)+2c(CH3COO-)
c.c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)
d.c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(5)已知:乙醛、乙醇的沸点分别为20.8℃、78.4℃.从电解后阴极区的溶液中分离出乙醇粗品的方法是
蒸馏
蒸馏
.(6)在实际工艺处理中,阴极区乙醛的去除率可达60%.若在两极区分别注入1m3乙醛的含量为3000mg/L的废水,可得到乙醇
1.9
1.9
kg(计算结果保留小数点后1位).分析:(1)b为原电池的负极,发生氧化反应,应通入甲烷;
(2)阳极发生氧化反应,生成乙酸和氧气,阴极发生还原反应,生成乙醇和氢气;
(3)硫酸钠不参与电解反应,物质的量不变;
(4)a.从离子交换膜的角度判断;
b.根据物料守恒判断;
c.从电荷守恒的角度分析;
d.醋酸为弱电解质,主要以分子形成存在.
(5)分离沸点不同的液体可用蒸馏的方法;
(6)根据电极反应式计算.
(2)阳极发生氧化反应,生成乙酸和氧气,阴极发生还原反应,生成乙醇和氢气;
(3)硫酸钠不参与电解反应,物质的量不变;
(4)a.从离子交换膜的角度判断;
b.根据物料守恒判断;
c.从电荷守恒的角度分析;
d.醋酸为弱电解质,主要以分子形成存在.
(5)分离沸点不同的液体可用蒸馏的方法;
(6)根据电极反应式计算.
解答:解:(1)b为原电池的负极,发生氧化反应,应通入CH4,故答案为:CH4;
(2)阳极发生氧化反应,生成乙酸和氧气,电极反应为CH3CHO-2e-+H2O═CH3COOH+2H+,阴极发生还原反应,生成乙醇和氢气,电极反应为4H++4e-═2H2↑或4H2O+4e-═2H2↑+4OH-,
故答案为:CH3CHO-2e-+H2O═CH3COOH+2H+;4H++4e-═2H2↑或4H2O+4e-═2H2↑+4OH-;
(3)硫酸钠不参与电解反应,物质的量不变,故答案为:不变;
(4)a.钠离子经过阳离子离子交换膜进入阴极,而硫酸根离子不能经过阳离子交换膜,则c(Na+)不一定是c(SO42-)的2倍,故a正确;
b.Na2SO4与CH3COOH的物质的量相同,则有c(Na+)=2c(CH3COOH)+2c(CH3COO-),故b正确;
c.电荷不守恒,应为c(Na+)+c(H+)=2c(SO42-)+c(CH3COO-)+c(OH-),故c错误;
d.醋酸为弱电解质,主要以分子形成存在,则有c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-),故d正确.
故答案为:abd;
(5)乙醛、乙醇的沸点的沸点不同,且相差较大,可用蒸馏的方法分离,故答案为:蒸馏;
(6)废水中乙醛的质量为1m3×3kg/m3=3kg,乙醛的去除率为60%,则反应的乙醛为1.8kg,
CH3CHO+2e-+2H2O═CH3CH2OH+2OH-
44 46
1.8kg x
x=1.9kg,
故答案为:1.9.
(2)阳极发生氧化反应,生成乙酸和氧气,电极反应为CH3CHO-2e-+H2O═CH3COOH+2H+,阴极发生还原反应,生成乙醇和氢气,电极反应为4H++4e-═2H2↑或4H2O+4e-═2H2↑+4OH-,
故答案为:CH3CHO-2e-+H2O═CH3COOH+2H+;4H++4e-═2H2↑或4H2O+4e-═2H2↑+4OH-;
(3)硫酸钠不参与电解反应,物质的量不变,故答案为:不变;
(4)a.钠离子经过阳离子离子交换膜进入阴极,而硫酸根离子不能经过阳离子交换膜,则c(Na+)不一定是c(SO42-)的2倍,故a正确;
b.Na2SO4与CH3COOH的物质的量相同,则有c(Na+)=2c(CH3COOH)+2c(CH3COO-),故b正确;
c.电荷不守恒,应为c(Na+)+c(H+)=2c(SO42-)+c(CH3COO-)+c(OH-),故c错误;
d.醋酸为弱电解质,主要以分子形成存在,则有c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-),故d正确.
故答案为:abd;
(5)乙醛、乙醇的沸点的沸点不同,且相差较大,可用蒸馏的方法分离,故答案为:蒸馏;
(6)废水中乙醛的质量为1m3×3kg/m3=3kg,乙醛的去除率为60%,则反应的乙醛为1.8kg,
CH3CHO+2e-+2H2O═CH3CH2OH+2OH-
44 46
1.8kg x
x=1.9kg,
故答案为:1.9.
点评:本题在电化学的基础上综合考查原电池和电解池的反应原理、物质的分离等知识,题目较为综合,难度中等,注意把握(4)题的做题思路和角度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2012?海淀区二模)室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
(2012?海淀区二模)室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )