网址:http://m.1010jiajiao.com/timu_id_904217[举报]
(1)下列铁制品中,利用金属导热性的是_______(填序号)。


(3)颗粒达到纳米级的单质铁具有很强的反应活性,俗称“纳米铁”。实验室制备的方法是:以高纯氮气作保护气,在高温条件下用氢气和氯化亚铁发生置换反应,生成“纳米铁”,反应的化学方程式为_______________________。
(4)氯化铁能腐蚀铜(2FeCl3+Cu==2FeCl2+CuCl2),工业上常用此原理生产印刷线路板。
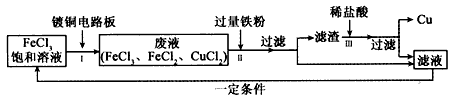
某钢铁厂高炉炼铁的主要原料是焦炭、赤铁矿(主要成分为Fe2O3)、空气等,主要反应过程如下所示:
![]()
(1)在上面方框中写出有关反应的生成物的化学式;
(2)写出②③两步反应的化学方程式。
②__________ ③__________
查看习题详情和答案>>
(2)写出②、③两步反应的化学方程式:
②________________________________;③________________________________。
节约资源和保护环境已经成为我们的基本国策。节能减排、环境保护和生态市建设是市政府近些年的工作重点。硫酸厂生产硫酸的流程是:把含硫矿物燃烧,生成二氧化硫,二氧化硫和氧气在高温和催化剂的作用生成三氧化硫,最后三氧化硫和水化合生成硫酸。写出三氧化硫和水化合生成硫酸的化学方程式
某纯碱样品中含有少量硫酸钠,现欲测定其碳酸钠的质量分数,利用含有少量硫酸的澄清废水进行如下实验:
《实验原理》Na2CO3+H2SO4= Na2SO4 + H2O + CO2↑通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数。
《实验装置》
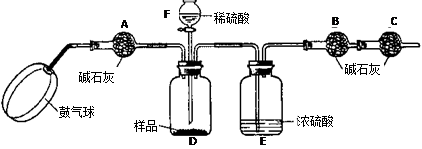
《实验步骤》
①如图连接装置(除B、C外)并加入所需药品。
②称量并记录B的质量(m1)。(称量时注意封闭B的两端。)
③按动鼓气球,持续鼓入空气约1分钟。
④连接上B、C。
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录B的质量(m2)。(称量时注意封闭B的两端及E右端的出口。)
⑧计算。
⑴已知碱石灰的主要成分是氢氧化钙和氢氧化钠,则干燥管A的作用是: ,以免使测定结果偏大。
(2) (能或不能)用稀盐酸代替稀硫酸,因为盐酸具有 性,会使测得碳酸钠的质量分数 (填偏大、偏小或不变,下同);若去除干燥管C,则测得碳酸钠的质量分数将会
(3)E装置的作用是
(4)本实验能否省略③、⑥两个步骤? (填能或不能),原因分别是 、
(5)若所取样品的质量为6g,分液漏斗F中盛放5%只含硫酸一种溶质的澄清废水,称得m1为51.20g,m2为53.40g,(计算结果保留两位小数)
求:(1)样品中碳酸钠的质量分数为多少?
(2)D装置中正好反应后,所得溶液的溶质质量分数是多少?
查看习题详情和答案>>
节约资源和保护环境已经成为我们的基本国策。节能减排、环境保护和生态市建设是市政府近些年的工作重点。硫酸厂生产硫酸的流程是:把含硫矿物燃烧,生成二氧化硫,二氧化硫和氧气在高温和催化剂的作用生成三氧化硫,最后三氧化硫和水化合生成硫酸。写出三氧化硫和水化合生成硫酸的化学方程式
某纯碱样品中含有少量硫酸钠,现欲测定其碳酸钠的质量分数,利用含有少量硫酸的澄清废水进行如下实验:
《实验原理》Na2CO3+H2SO4= Na2SO4 + H2O + CO2↑通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数。
《实验装置》

《实验步骤》
①如图连接装置(除B、C外)并加入所需药品。
②称量并记录B的质量(m1)。(称量时注意封闭B的两端。)
③按动鼓气球,持续鼓入空气约1分钟。
④连接上B、C。
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录B的质量(m2)。(称量时注意封闭B的两端及E右端的出口。)
⑧计算。
⑴已知碱石灰的主要成分是氢氧化钙和氢氧化钠,则干燥管A的作用是: ,以免使测定结果偏大。
(2) (能或不能)用稀盐酸代替稀硫酸,因为盐酸具有 性,会使测得碳酸钠的质量分数 (填偏大、偏小或不变,下同);若去除干燥管C,则测得碳酸钠的质量分数将会
(3)E装置的作用是
(4)本实验能否省略③、⑥两个步骤? (填能或不能),原因分别是 、
(5)若所取样品的质量为6g,分液漏斗F中盛放5%只含硫酸一种溶质的澄清废水,称得m1为51.20g,m2为53.40g,(计算结果保留两位小数)
求:(1)样品中碳酸钠的质量分数为多少?
(2)D装置中正好反应后,所得溶液的溶质质量分数是多少?
查看习题详情和答案>>